导读
噬菌体是地球上最丰富和最多样化的生物实体,对细菌宿主产生特定的影响。噬菌体和细菌在肠道内的共存是动态的、相互依存的。噬菌体参与维持细菌群落的稳定性和组成,肠道中噬菌体和细菌的失衡可能引起疾病。本文综述了人体肠道中噬菌体与细菌之间的相互作用及其在疾病发病和治疗中的作用。了解噬菌体、细菌和宿主疾病之间的关系,将有利于促进噬菌体在人类疾病治疗中的应用。
论文ID
原名:Intestinal phages interact with bacteria and are involved in human diseases
译名:肠道噬菌体与细菌相互作用并参与人类疾病
期刊:Gut Microbes
IF:9.434
发表时间:2022.8
通讯作者:丁克峰
通讯作者单位:浙江大学医学院附属第二医院
DOI号:10.1080/19490976.2022.2113717
综述目录
1 前言
2 肠道内噬菌体与细菌之间的关系
2.1 噬菌体侵袭对肠道菌群的影响
2.2 肠道细菌对噬菌体侵袭的拮抗机制
2.3 噬菌体和细菌在肠道内持续共存
3 肠道噬菌体通过调节特定的细菌代谢和启动免疫反应来诱发疾病
4 噬菌体在肠道疾病治疗中的应用
主要内容
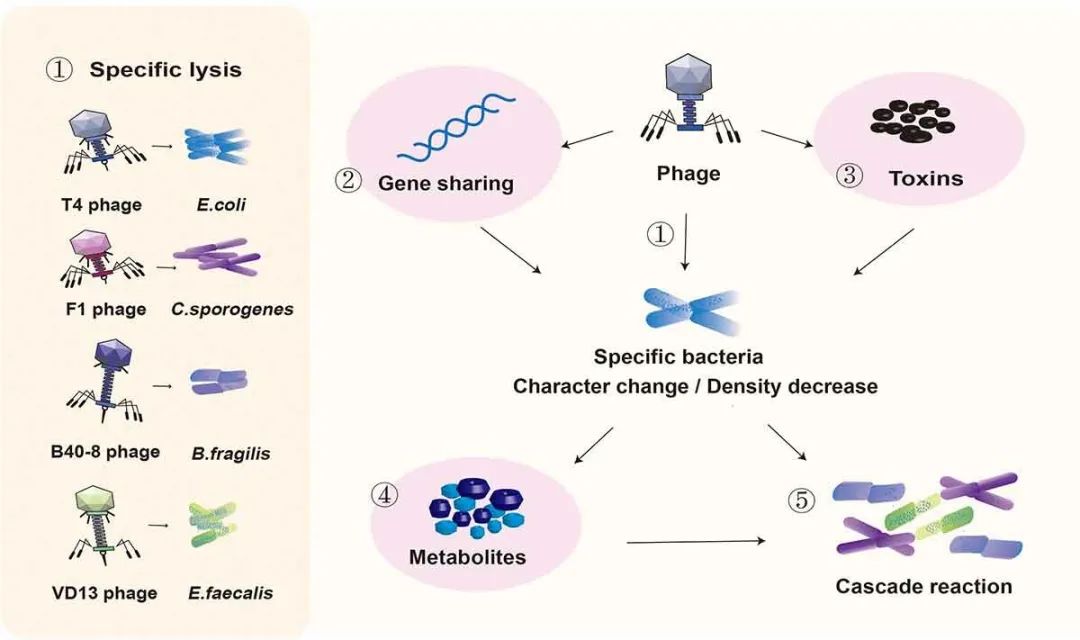
人体是由自身细胞和大量共生微生物组成的复杂的共生有机体。人体微生态包括肠道微生态、皮肤微生态和呼吸道微生态等。而肠道微生态是人体微生态系统中最重要的。肠道微生态失衡可能会诱发全身性疾病。Eckburg PB等人在健康个体结肠粘膜和粪便的多个部位检测到13,355个原核核糖体RNA基因序列,每个个体的肠道中至少存在1000种已知细菌。98%的肠道细菌可被分类为拟杆菌门、厚壁菌门、变形菌门和放线菌门。剩下的大多数细菌尚未被鉴定,可认为是未培养的物种和未识别的微生物。此外,肠道中有数千种病毒。通过分析世界各地收集的28,000多个肠道微生物组样本和2898个培养肠道细菌的参考基因组,EMBL-EBI研究人员在人类肠道中鉴定到超过140,000个非冗余肠道噬菌体基因组。Liang G等人和Carding SR等人认为人体肠道内的噬菌体‒细菌比率基本上保持在1:1。噬菌体是人类肠道中最常见的病毒(每毫升粪便滤液中可高达108个病毒样颗粒(VLPs))。噬菌体的一个特殊属性是它们仅存在于细菌中。噬菌体最早于1915年在葡萄球菌(Staphylococcus)和志贺氏菌(Shigella)中发现,其中最为著名的是以大肠杆菌(Escherichia coli)为宿主的噬菌体T4。噬菌体与其他类型的病毒具有相似的特征,即尺寸小(以大肠杆菌T4噬菌体为例,其头部尺寸约为95×65 nm,尾部长度为95~125 nm,管状结构直径为13~20 nm),没有完整的细胞结构,只有一个核酸片段。根据噬菌体的生命周期,它们可被分为溶原噬菌体和裂解噬菌体。溶原噬菌体,也称温和噬菌体,可将其病毒遗传物质整合到宿主细菌的基因组中,它们的DNA或RNA通过正常细胞分裂被细菌染色体复制,无需细胞裂解。相比之下,裂解噬菌体的复制周期相对复杂,通过以下四个过程导致宿主细胞裂解:吸附、侵入、增殖和释放。根据噬菌体在人体肠道中存在的频率,它们可进一步划分为低相容性噬菌体、常规噬菌体和核心噬菌体,分别在人群中占2-19%、20%-50%和50%以上。最近的研究中发现分布最广泛的肠道噬菌体是一种可以感染拟杆菌的噬菌体,称为“crAssphage”。噬菌体通常与单个细菌菌株相互作用。噬菌体-细菌相互作用网络是嵌套化和模块化的。尽管噬菌体-细菌的进化可能受到器官和组织以及相互作用网络的复杂性影响,但这些相互作用仍是持续进化。噬菌体活性会影响宿主细菌的数量和行为,并在宿主炎症期间介导细菌之间的基因转移。噬菌体与微生态平衡和失衡有关,它们可以通过捕食细菌生态景观或通过更间接的途径来影响人体健康,如影响新陈代谢和免疫系统。调节噬菌体和细菌之间的关系可以维持身体健康,甚至逆转疾病。在20世纪30年代,美国曾用噬菌体对抗感染,之后对它们的使用进行了大规模的成功临床试验。随后,噬菌体在南美洲被广泛用于预防和治疗细菌性痢疾和葡萄球菌感染。近年来,噬菌体也已广泛用于超灵敏生物标志物检测、疾病诊断的增强生物成像、靶向药物和基因递送、有效疫苗接种、替代抗生素用于灭菌等。本文详细讨论了噬菌体对细菌的作用模式、细菌对噬菌体的排斥模式以及噬菌体与细菌在人体肠道中的共同进化。进一步讨论了噬菌体与宿主疾病之间的关系及其在医学领域的最新应用。研究噬菌体的治疗潜力可为噬菌体作为抗菌剂提供参考。噬菌体特异性裂解易感菌。埃希氏菌属(Escherichia)病毒PDX是严格裂解性肌病毒科(Myoviridae)的成员之一。据报道,肌病毒科噬菌体PDX以剂量依赖性方式杀灭了从儿童体内分离的与疾病相关的肠聚集性大肠杆菌(EAEC)。Cepko LCS等人进一步发现,EAEC可减少人类微生物群的β多样性,而肌病毒科噬菌体PDX可以杀灭EAEC但不会引起人类微生物组失调。将裂解噬菌体注射到用一组已鉴定的人类共生细菌定殖的常规小鼠中,采用高通量测序和定量PCR对每一种微生物的反应进行纵向跟踪,发现噬菌体T4、F1、B40-8和VD13分别只裂解它们的易感细菌大肠杆菌、Clostridium sporogenes、脆弱拟杆菌(Bacteroides fragilis)和粪肠球菌(Enterococcus faecalis)。这些噬菌体对其他共生细菌没有显著影响。体外小肠模型用于分析DSM 1058噬菌体制剂对预选目标大肠杆菌和非目标细菌种群的影响。该研究发现,大肠杆菌DSM 1058的噬菌体制剂仅影响了大肠杆菌的种群数量。然而,肠道模型中包括的其他“共生”细菌物种没有受到影响,如唾液链球菌(Streptococcus salivarius)、Streptococcus lutetiensis和粪肠球菌。噬菌体通过水平基因转移影响肠道菌群。噬菌体可以通过菌株特异性捕食显著塑造生态系统结构,并通过裂解宿主细菌介导水平基因转移。能够包装细菌宿主DNA并将其转移到新宿主的噬菌体通常称为转导噬菌体。金黄色葡萄球菌携带毒素的高流动性致病岛(SAPI)特别适合通过特定的葡萄球菌噬菌体进行包装和转移。SaPI编码的毒性休克综合征毒素1(TSST-1)和其他超级抗原在插入特定的染色体位点后,可被温和噬菌体切除和复制。复制后,SaPI DNA被包装成特殊的小感染颗粒然后进行特定的转移。通过监测Fels-1原噬菌体中sodCII::neo盒(一个基因序列)从LT2到受体沙门氏菌菌株的转导,Bearson BL等人证实了卡巴多诱导噬菌体介导的基因转移。在多重耐药菌株DT104和DT120中,卡巴多诱导噬菌体的广义转导,导致染色体和含有抗生素抗性基因(ARGs)的质粒DNA转移。Modi等人建立环丙沙星和氨苄西林耐药小鼠模型,并且检测了小鼠粪便中的噬菌体。结果发现环丙沙星耐药小鼠粪便中的噬菌体携带编码喹诺酮类外排泵的基因(如NorM、mexD和mexF),而氨苄西林耐药小鼠中的噬菌体则携带编码细胞壁合成抑制剂传感器和反应调节因子的基因(如VanRS)(reads增加3倍)。该研究结果表明,噬菌体可以通过编码抗生素耐药基因来调节抗生素处理细菌的耐药性。通过重新分析Modi等人论文中的数据,Enault等人发现纯细菌的直系同源蛋白质簇也增加了两到三倍。在环丙沙星和氨苄西林处理的小鼠微生物宏基因组中,各种细菌基因的检测频率更高,而对ARGs无特殊选择。这可能是由于抗生素处理诱导了原噬菌体,一些原噬菌体亚群进行了广义转导。抗生素处理扩大了噬菌体和细菌物种之间的相互作用,导致噬菌体和细菌之间的基因交换网络连接更为紧密。噬菌体编码细菌种群的毒力因子。噬菌体可以在菌株之间传播毒力因子,包括许多导致疾病的毒素编码基因,如白喉、霍乱、痢疾和猩红热。霍乱弧菌(Vibrio cholerae)是霍乱病原体,需要两个调节因子协调才能产生完全毒力,即霍乱毒素和毒素协同调节菌毛。霍乱毒素的结构基因由丝状噬菌体CTXφ编码,并且由CTXφ基因组充当其染色体整合或复制质粒。噬菌体CTXφ的El Tor突变会破坏两种细菌编码的酪氨酸重组酶XerC和XerD,这两种酶通常在染色体二聚体的分解中起重要作用。噬菌体CTXφ在霍乱弧菌的两条染色体中较大二聚体的分解位点DIF1处整合,导致霍乱流行菌株的遗传多样性,进而影响霍乱弧菌释放霍乱毒素。产志贺毒素大肠杆菌(STEC)中的毒素由常驻温和lambdoid噬菌体编码。温和lambdoid噬菌体可能含有毒素结构基因或宿主细菌转导的毒素结构基因的调节因子。当噬菌体被诱导离开其休眠状态并开始复制时,志贺毒素(Stx)基因出现表达。广泛的噬菌体复制会导致大肠杆菌释放大量Stx。Stx基因位于噬菌体PR启动子的下游,启动子的转录和Stx的表达受Q抗终止蛋白控制。Q抗终止蛋白仅在噬菌体裂解介导的生长过程中表达,因此携带Q21亚型的噬菌体会产生较少量的Stx。噬菌体参与细菌代谢调控。噬菌体靶向细菌物种的特异性捕食可以消除相关细菌代谢物的产生。监测重度抑郁症患者和健康人肠道中不同噬菌体和细菌代谢物的相对丰度并由此构建共生网络,表明克雷伯氏菌噬菌体(vB KpnP SU552A)丰度与拟杆菌属呈正相关,并与脯氨酸、半胱氨酸和色氨酸水平呈负相关,影响氨基酸代谢。色胺是一种神经递质,由少数共生肠道细菌的色氨酸脱羧而产生。色氨酸脱羧酶编码基因已在诸如Ruminococcus gnavus和C. sporogenes等物种中发现。Hsu BB等人首先使用BLAST从C. sporogenes(clospo_02083)中搜索色氨酸脱羧酶氨基酸序列,并与菌群其他成员进行了比对。该结果表明,来自C. sporogene(clospo_02083)色氨酸脱羧酶的氨基酸序列与该联合体的其他成员具有较差的蛋白质同源性(同源性最高为31%)。来自C. sporogene的色氨酸脱羧酶的氨基酸序列与C. sporogene保持着独特联系。然后,研究人员从被特定细菌群落定殖的无菌小鼠中收集粪便样本,并用T4和F1噬菌体对其进行处理。用T4和F1噬菌体处理期间,研究人员检测到色胺水平降低了10倍、17倍和2倍(分别在0.3、2和13天)。粪肠球菌通过酪氨酸脱羧作用特异性地产生神经递质酪胺。未发现酪氨酸脱羧酶与其他菌群成员有关联,也没有发现任何与粪肠球菌具有显著同源性的蛋白质。用噬菌体处理粪肠球菌,酪氨酸含量在0.3天时降低了4倍,在2天时降低了2.7倍,在13天时降低了4倍。从Atp4aSl/Sl小鼠粪便中分离粪肠球菌菌株,用于粪肠球菌噬菌体的分离。从未经处理的原污水中分离出粪肠球菌噬菌体Efmus1、Efmus2、Efmus3和Efmus4。通过管饲法将三种或四种不同的靶向溶细胞性粪肠球菌(1010 PFUs)的噬菌体施用于小鼠,结果发现噬菌体可以显著降低肠球菌的数量和溶菌素水平。噬菌体可能通过溶原途径改变其靶宿主的基因组成,影响代谢物相关基因的表达,进而导致代谢物水平的升高或降低。噬菌体与其他细菌存在级联的相互作用。噬菌体在减少其靶菌数量后,还会通过级联效应影响肠道共生菌群中的非目标菌种,使肠道菌群总数基本稳定。例如,大肠杆菌通过相互作用网络促进B. fragilis的生长,抑制Bacteroides vulgatus的生长。噬菌体T4对大肠杆菌的消耗会导致B. fragilis的生长抑制和Bacteroides vulgatus的生长促进。此外,噬菌体持续应用于小鼠后,各组小鼠的肠道微生物组差异程度逐渐降低。这一发现间接表明,噬菌体捕食可能有助于细菌群落的稳定。噬菌体接种对肠道菌群的影响见图1。图1 噬菌体接种对肠道菌群的影响。①噬菌体T4、F1、B40-8和VD13仅裂解其易感菌大肠杆菌、C. sporogenes、B. fragilis和粪肠球菌。噬菌体通过①特异性裂解,②水平基因转移和③编码毒力基因直接影响易感菌,导致肠道细菌发生变化,数量减少。④分泌的代谢物类型可能因细菌特性的改变而改变,分泌的代谢物总量可能因细菌数量的减少而减少。⑤细菌及其代谢物丰度的变化会影响肠道环境和周围细菌的生长。人类是地球生态环境的重要组成部分。肠道是与外界环境直接相接的人体器官。微生物生活在外界环境中也生活在人类肠道中并发挥着类似的功能。与环境中一样,细菌和噬菌体在肠道中共存于一个复杂且结构化的相互作用网络中。(I)细菌通过改变或隐藏受体来阻止噬菌体吸附。噬菌体可用细菌表面的受体结合蛋白(RBPs)来感染它们的靶细菌。RBPs属于不同的生化家族,主要以表面蛋白、多糖和脂多糖(LPSs)为代表。细菌阻止噬菌体与受体结合是通过调节受体表达、突变受体和隐藏受体进行。例如,霍乱弧菌通过调节manA和wbeL(O1抗原生物合成所需的两个可变基因)的表达来降低O1抗原表达,这有助于避免噬菌体吸附。大肠杆菌F菌株可以产生外膜蛋白(OMP) TraT和通过掩盖或修饰OmpA构象来防止噬菌体吸附。模拟葡萄球菌菌株的荚膜抑制噬菌体U16与其受体结合,从而抑制噬菌体U16的吸附。噬菌体通过多糖与假单胞菌结合。为了预防感染,假单胞菌会选择在很多与粘液转化相关的常见位点进行突变,包括mucA和algU,并抑制粘液样变。然而,噬菌体也不是静态的,可以通过改变它们的结构以结合新的受体。λ噬菌体的RBP由J基因编码,可以与宿主表面受体LamB结合。当LamB基因的表达受到抑制时,噬菌体可通过改变蛋白J的末端结构并与新的受体蛋白OmpF结合来完成后续感染。微小的修饰也可以伪装噬菌体的受体。大肠杆菌K1荚膜可阻断噬菌体T7感染,且铜绿假单胞菌(Pseudomonas aeruginosa) O抗原修饰和IV型菌毛糖基化也可以阻断噬菌体感染。然而,当大肠杆菌产生的荚膜掩盖了其LPS受体时,噬菌体H4489A通常会编码细胞外透明质酸裂解酶以降解荚膜,从而帮助吸附。此外,细菌也可以通过产生细胞外基质和竞争性抑制剂来防止噬菌体吸附。大肠杆菌和霍乱弧菌可通过外膜囊泡(OMVs)上提供的噬菌体敏感受体来减少噬菌体感染。大肠杆菌FhuA是一种铁转运蛋白和T5噬菌体的进入端口。抗菌分子Microcin J25通过使用FhuA作为其受体,并与噬菌体T5竞争结合位点导致感染的成功率降低。(II)细菌通过限制性修饰破坏噬菌体DNA,抑制噬菌体基因的整合和复制。细菌限制性修饰是指细菌在基因组的特定位点上通过甲基化标记其遗传物质,因此未标记的DNA会被许多内切酶识别、切割和降解。I型、II型和III型限制性修饰(R-M)系统具有甲基转移酶和限制性内切酶,可通过切割其独特的密码识别无法识别的DNA来保护宿主。与限制性修饰甲基化酶相关的防御岛系统(DISARM)是一种广泛存在的细菌防御系统,它可以修饰宿主CCWGG基序(W=A或T)作为自身DNA标记。Vibrio cyclitrophicus、大肠杆菌和Streptomyces yokosukanensis中的SspABCD-SspE磷酸(PT)系统构成了对多种噬菌体的防御屏障。SspABCD提供单链和高频PTs。SspABCD中的SspB以镍酶的形式与SspE结合。SspE可通过其PT刺激的NTPase活性来感知序列特异性PTs,从而发挥其抗噬菌体活性,而SspE可通过引入缺口损伤来损害噬菌体DNA复制来抑制噬菌体的繁殖。BREX(用于噬菌体排斥)是细菌常见防御系统的超家族,例如枯草芽孢杆菌(Bacillus subtilis)。细菌通过使用BrxX(PglX)甲基转移酶甲基化特定不对称位点来区分自身DNA和非自身DNA。未甲基化的噬菌体DNA将无法复制并与细菌DNA整合。在I型R-M系统中,噬菌体编码蛋白质,可与限制性复合物结合并阻止其与噬菌体DNA中未修饰的识别位点结合。这类蛋白质的原型是裂解性噬菌体T7基因0.3的产物OCR(克服经典限制)。作为一种DNA模拟物,OCR可结合许多与核酸相互作用的宿主蛋白(如DNA依赖性RNA聚合酶)。Goldfarb T等人发现OCR通过特异性结合BrxX甲基转移酶来克服大肠杆菌的BREX防御。(III)细菌通过CRISPR-cas系统降解噬菌体DNA。自然成簇的规律间隔短回文重复序列(CRISPR)系统分为三个阶段:适应、表达和干扰。在适应阶段,来自入侵质粒或病毒的外源DNA片段(约30-45个核苷酸,也称为前间隔子)被整合到CRISPR序列中作为新的间隔子。从外源DNA中选择天然间隔子是基于前间区序列邻近基序(PAM)。新的间隔区为特定序列提供储存,以抵御相应的入侵质粒或病毒。在表达阶段,CRISPR阵列被转录成pre-CRISPR RNA,进一步加工为成熟的CRISPR RNA(crRNA)。每个crRNA都包含一个保守的重复序列和一个与外源DNA互补的转录区间。crRNA文库可以靶向多个遗传元件,因为每个crRNA对应于一个入侵序列。在干扰阶段,crRNA作为特异性靶向PAM的向导,Cas9切割匹配的DNA。噬菌体DNA插入到CRISPR基因簇中形成一个新的间隔序列,该序列被转录成crRNA。当噬菌体再次入侵时,crRNA作为识别标记可将Cas蛋白引导至噬菌体DNA,然后作为核酸内切酶降解噬菌体DNA。例如,Serrella III-A CRISPR-Cas复合物可阻断噬菌体感染,来自leptinVI型系统的Cas13可剪切大肠杆菌中的噬菌体MS2 RNA。然而,在感染铜绿假单胞菌的噬菌体基因组中发现了五种不同的“CRISPR抗性”基因。噬菌体CRISPR抗性基因的突变阻止了它们感染携带功能性CRISPR/Cas系统的细菌。霍乱弧菌血清组O1噬菌体可以编码其自身功能性CRISPR-Cas系统的部分基因序列,可在感染初期靶向功能性CRISPR-Cas系统,破坏宿主抗噬菌体防御系统。ICP1_2011_A噬菌体通过ICP1靶向霍乱弧菌O1 El Tor菌株。ICP1噬菌体CRISPR/Cas系统由6个Cas基因和两个CRISPR位点(CR1和CR2)组成。PLE1的基因组组织靶向ICP1相关噬菌体的CRISPR/Cas系统。从霍乱患者的粪便中分离出11个与ICP1相关的噬菌体,其中5个编码位于祖先ICP1基因组的ORF87和ORF88之间的CRISPR/Cas系统,该CRISPR/Cas系统的GC含量与ICP1基因组的其余部分相同(约37%)。(Ⅳ)细菌通过超感染免疫系统阻止噬菌体DNA的再侵入。超感染排除(SIE)是指当宿主细菌被一种噬菌体感染并且另一种类似的噬菌体被吸附在宿主细胞表面时,可能锚定在膜上或与膜上元素相关的蛋白质发挥作用,从而防止类似噬菌体引起继发感染的过程。Arguijo Hernández ES等人提供了遗传和生物化学证据,证明大肠杆菌mEp167 Cor蛋白是一种OMP。Cor与OMP相互作用,包括OmpA、OmpC、OmpF和OmpW。Cor在大肠杆菌mEp167溶原性噬菌体菌株中排除了fHUa依赖性噬菌体。携带溶原性噬菌体P22的鼠伤寒沙门氏菌(Salmonella typhimurium)的双重感染排除了A(SieA)系统可以预防噬菌体LMG178.61的感染。当细菌细胞被T-偶数噬菌体感染时,噬菌体编码的蛋白质Imm和Sp会迅速出现。Imm可防止DNA跨质膜转移并部分抑制再感染病毒粒子的DNA释放,而Sp则可抑制噬菌体相关溶菌酶对细菌壁蛋白的局部降解。(Ⅴ)细菌通过abi系统感染导致噬菌体裂解失败。流产感染(Abi)系统是一种机制,通过这种机制,在感染后但在噬菌体繁殖完成之前诱导细胞死亡,从而保护种群中未感染的同类。Rex系统是Abi系统的其中之一。RexAB的大肠杆菌噬菌体λ是一个典型的Abi系统。Rex系统可以被噬菌体的蛋白质-DNA复合物激活。当Rex系统被触发时,RexA蛋白激活RexB蛋白,形成膜通道,导致ATP泄漏、膜电位丧失和噬菌体排泄受阻。Abi系统可导致受感染细胞死亡,通常不产生成熟的病毒颗粒。尽管这一系统已经研究了几十年,但由于Abi系统的复杂性和多样性,我们仍然没有完全理解其作用模式。还有另一种Abi系统,称为毒素-抗毒素(TA)机制。这种机制是基于毒素和抗毒素之间的相互作用。在感染T4和其他噬菌体后,大肠杆菌中核糖核酸内切酶毒素-N被激活。核糖核酸内切酶毒素-N可通过切割病毒mRNA并抑制其翻译从而阻止噬菌体的发育。这种毒素靶向基本细胞过程,导致细菌冬眠或同时死亡。例如,对于携带PemIK(PemK/PemI) II型TA系统的肺炎克雷伯菌的lncL质粒,PemK毒素的过表达会导致细菌休眠。为了绕过毒素,噬菌体可以编码抗毒素。抗毒素可以竞争毒素的相同结合位点使其功能失效。再者,抗毒素也可以选择中和毒素的毒性。噬菌体可以通过重组获得宿主遗传物质而产生多种逃逸方式,并且重组也可以促进噬菌体获得抗毒素。肠道细菌对噬菌体入侵的拮抗机制如图2所示。
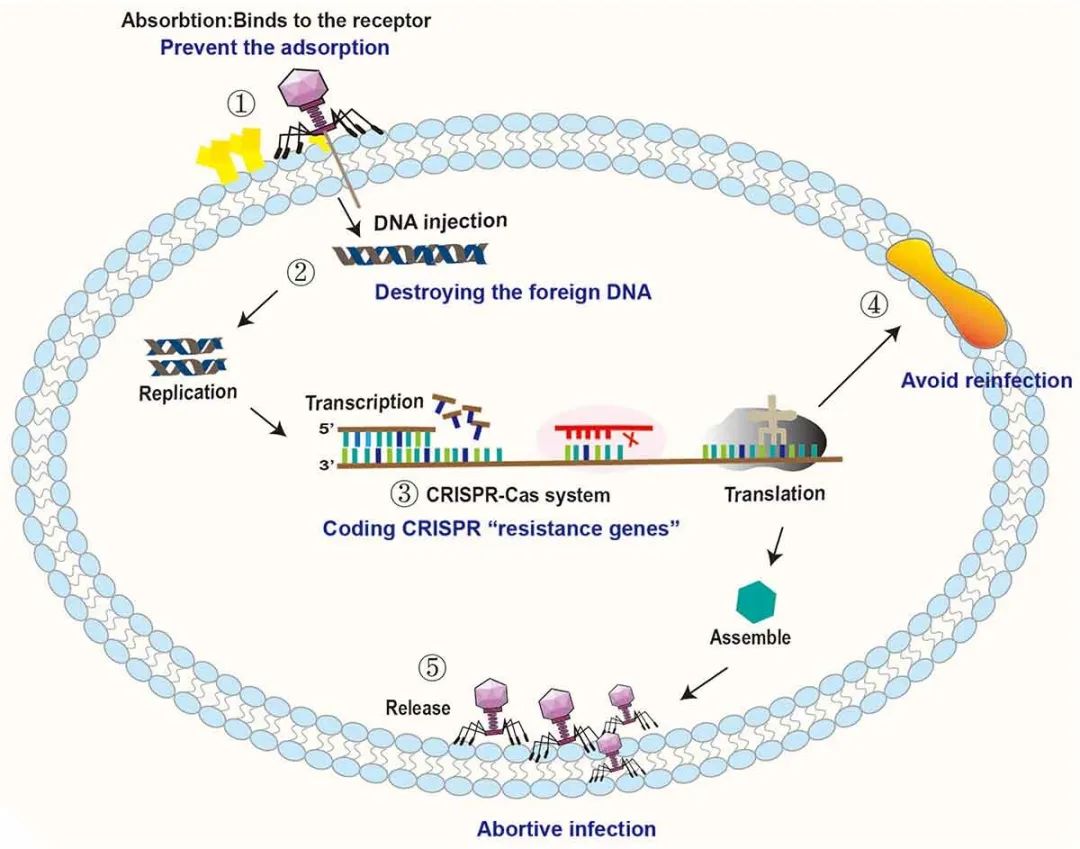
图2 肠道细菌对噬菌体入侵的拮抗机制。①细菌可以通过改变和隐藏受体来阻止噬菌体的吸附。②细菌通过限制性修饰-甲基化途径破坏入侵噬菌体的DNA,抑制噬菌体基因的复制和整合。③细菌通过CRISPR-Cas系统降解噬菌体DNA。④细菌通过编码重复感染免疫系统蛋白来防止再感染。⑤细菌通过Abi系统干扰噬菌体的吸附、入侵、复制、组装和释放,导致噬菌体裂解失败。
噬菌体是肠道微生物群的核心成员和潜在调节因子,在维持肠道微生物群落的结构和功能方面发挥着至关重要的作用。最近研究表明,施用强毒性噬菌体可以强烈影响目标细菌的肠道定殖,但仍支持长期共存。噬菌体和肠道细菌的长期共存值得考虑。噬菌体通过维持与其微生物猎物的共同进化的相互作用来驱动和维持肠道微生态的稳定性和多样性。生存竞争、基因转移和其他因素会参与微生物群落的形成和更新。噬菌体和细菌之间的特定相互作用、防御和反防御之间的竞争以及基因共享形成新突变和新物种的机制组合都促进着共同进化。噬菌体的复制和生存依赖于细菌宿主。高密度的细菌有利于噬菌体的存活。基于此,“密度依赖性”假说指出细菌越多,噬菌体就越多。关于病毒和细菌生存的两种相互竞争的理论是有趣的。一种是杀死获胜者模型,另一种是搭乘胜利者模型。当生态系统中的细菌密度增加时,细菌被称为获胜者。随着生态系统中细菌密度的增加,感染这些细菌的噬菌体数量也会增加。人们普遍认为,这种不断增长的噬菌体种群会杀灭越来越多的细菌,从而限制种群规模。这就是所谓的“杀死获胜者”模型。“搭乘胜利者”模型指的是一种假设,即随着潜在宿主细菌越来越多,一些病毒会放弃快速繁殖,反而选择在宿主中保持自身稳定。这些病毒的繁殖速度较慢,避免与其他病毒竞争,并避免与宿主自身的免疫防御接触。这两种看似矛盾的理论实际上是噬菌体的生存方式。此外,最新研究提出了一种称为细菌空间分布的理论,该理论表明结构化环境(肠绒毛)可以作为细菌的空间避难所,使其能够逃脱噬菌体的捕食,这导致细菌和噬菌体共存。噬菌体对肠道共生菌的杀灭具有特异性。在肠道微生态系统中,噬菌体和共生细菌具有杀伤特异性,但也有一些噬菌体和共生细菌不能相互作用。噬菌体和细菌在肠道内持续共存的原因如图3所示。
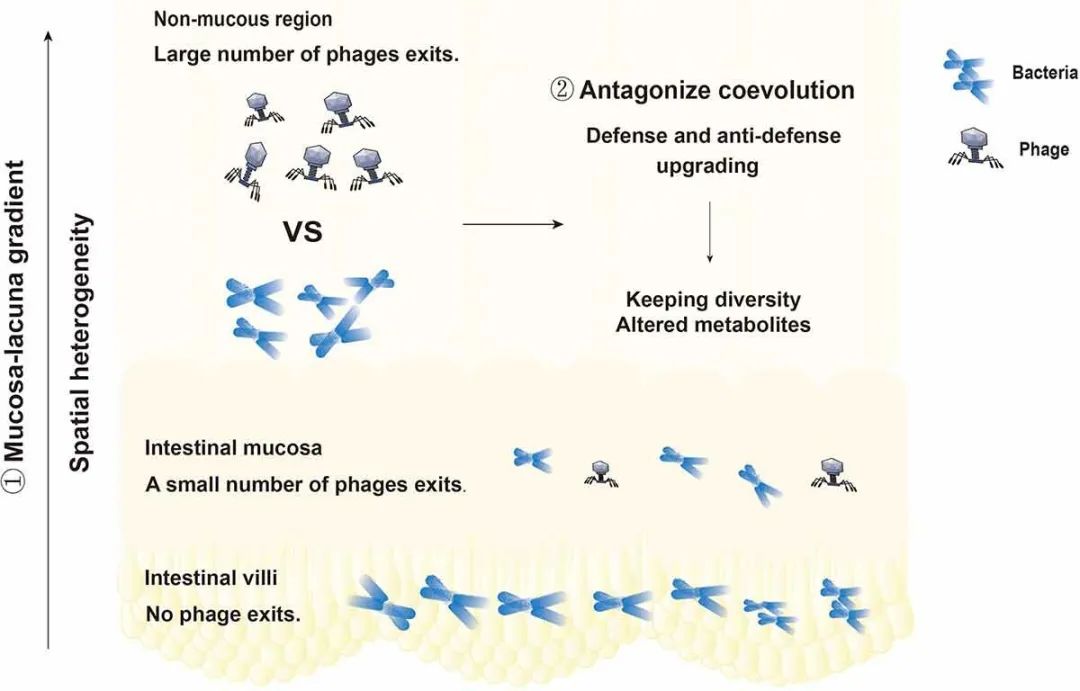
图3 噬菌体和细菌在肠道内持续共存的原因。①噬菌体和细菌的分布具有空间异质性。肠绒毛内无噬菌体,肠黏膜内噬菌体少,肠腔内有大量噬菌体。肠道内噬菌体密度呈黏膜-腔梯度,为细菌提供了躲避噬菌体攻击的场所。②噬菌体与细菌的特异性相互作用,防御与反防御系统之间的竞争以及基因共享形成新突变或新物种的方式促进了协同进化。
3 肠道噬菌体通过调节特定的细菌代谢和启动免疫反应来诱发疾病(I)噬菌体通过免疫反应调节结肠炎。肠道微生物与结肠炎等肠道疾病密切相关。Norman JM等人观察到克罗恩病和溃疡性结肠炎(UC)患者的肠道细菌种群多样性下降,疾病的发生与有尾噬菌体目噬菌体的显著扩增有关。噬菌体裂解细菌释放细菌表面分子和细胞间内容物是通过激活免疫系统Toll样受体(TLR)信号传导或通过调节细菌群落和诱导肠道炎症来影响免疫反应。Liu L等人发现共生病毒,如噬菌体由肠道抗原呈递细胞(APCs)中表达的RIG-I受体识别。RIG-I受体通过MAVS-IRF-1信号通路促进IL-15的产生,增强CD8ααα+TCR-αβ+和CD8αβ+TCR-αβ+上皮内淋巴细胞(IELs)的活性与功能。小鼠缺乏常见病毒或MAVS更有可能患上葡聚糖硫酸钠(DSS)诱导的结肠炎,并且通过补充IL-15来恢复这些小鼠的IEL可降低对DSS的易感性。Gogokhia L等人表明,乳杆菌噬菌体、大肠杆菌噬菌体和拟杆菌噬菌体可通过核苷酸感应受体TLR9来刺激干扰素-γ(IFN-γ)的产生。内化的噬菌体触发TLR-9信号传导后,噬菌体表位可呈递给CD4+T细胞,导致IFN-γ的产生和肠道炎症反应的激活。噬菌体通过TLR9和IFN-γ来加剧结肠炎。在粪便微生物群移植(FMT)前和FMT后4周,Gogokhia L等人对20名活动性UC患者进行了总核酸测序,发现对FMT有临床反应的患者的Caudovirales噬菌体相对丰度低于对治疗无反应的患者。黏膜IFN-γ水平与噬菌体水平呈正相关,活动性UC患者噬菌体诱导的IFN-γ比健康个体更多。Adiliaghdam F等人发现,从非炎症性肠病(IBD)个体中富集的噬菌体可以主动引发非典型抗炎先天免疫程序。从IBD个体中富集的噬菌体发散性地引发促炎巨噬细胞反应。增加粪便中非IBD相关噬菌体的比例可以部分恢复巨噬细胞产生IL-22等抗炎细胞因子的能力。利用噬菌体可能为IBD提供治疗潜力。(II)噬菌体通过改变细菌群落结构和调节免疫微环境影响结直肠癌。Nakatsu G等人通过对香港74名结直肠癌(CRC)患者和92名非CRC患者的粪便样本进行鸟枪法宏基因组分析,发现肠道病毒种群失调与早期和晚期CRC有关。Zheng DW等人在患有CRC的人群和小鼠中都观察到有害Fusobacterium nucleatum的过量繁殖,同时抑制了有益Clostridium butyricum的增殖。感染革兰氏阴性细菌宿主的噬菌体都与CRC有关,如产肠毒素的B. fragilis、大肠杆菌和Clostridium nucleobacter。Hannigan等人通过16S rRNA基因、鸟枪法宏基因组和纯化病毒宏基因组测序分析了来自30名健康个体、30名腺瘤患者和30名CRC患者的粪便样本。该分析结果表明,与癌症相关的病毒组主要由温和噬菌体组成,可以通过调节细菌群落的组成来间接诱导癌症发展。此外,噬菌体能够扩散到身体中包括血液、淋巴液、器官、甚至大脑在内的无菌区域。Nguyen S等人通过将噬菌体T4与T84(结肠上皮)细胞和CaCo2(结肠上皮)细胞共同孵育,多种噬菌体在源自肠道的融合细胞层上的快速定向转胞吞作用。噬菌体可以进入真核细胞的囊泡区和胞质区,而经细胞转运的噬菌体可以通过内膜系统进入高尔基体。肠道内有促癌细菌和抑癌细菌。同样,肠道中可能存在促进癌症的噬菌体和抑制癌症的噬菌体。某些微生物抗原能够刺激记忆T细胞宿主的适应性免疫反应并对噬菌体和肠道微生物群具有活性。一些肠道微生物抗原可以刺激记忆T细胞。与此同时,与肿瘤相关抗原发生交叉反应的肠道微生物可以激活特异性分泌IFN-γ的CD4+和CD8+ T细胞,有助于抗肿瘤免疫反应。Flukiger等人发现共生细菌Enterococcus hirae含有一种前噬菌体,它在其卷尺蛋白(TMP)中编码MHCI类限制性抗原。由含有前噬菌体的大肠杆菌定殖的小鼠在环磷酰胺处理后可以诱导TMP特异性CD8+ T细胞反应。此外,噬菌体TMP1中模拟致癌肽PSMB4的表达可以有效抑制肿瘤的生长,从而提高免疫治疗的效果。Murgas P等人证明单链DNA的M13噬菌体具有高免疫原性,可以特异性靶向肿瘤细胞表面,从而引发炎症和活化的先天免疫细胞侵袭,克服肿瘤相关免疫抑制,促进抗肿瘤免疫。Dong X等人通过将银纳米粒子(AgNPs)静电组装在与梭菌特异性结合的M13噬菌体的表面衣壳蛋白(M13@Ag)上,实现了对梭菌共生的特异性消除。M13噬菌体可通过激活APC来激活宿主免疫系统并抑制CRC发展,以改变肿瘤免疫微环境并减少肿瘤部位的髓源性抑制细胞(MDSC)的扩增。(III)噬菌体通过增加细菌外毒素释放诱导酒精性肝病发展。酒精性肝炎是酒精相关性肝病(ALD)最严重的疾病形式,死亡率高达40%。Lu Jiang等人从一项多中心观察性研究中纳入的89例酒精性肝炎患者的粪便中提取VLP,并进行宏基因组测序以表征肠道病毒。结果显示,在酒精性肝炎患者粪便样本中,病毒组的多样性最高。Escherichia、Enterobacteria和Enterococcus噬菌体的丰度异常高,而哺乳动物病毒的数量显著增加,如Parvoviridae和Herpesviridae。Duan Y等人比较酒精性肝炎患者、酒精使用障碍患者和健康对照组,发现酒精性肝炎组肠道菌群中的E. faecalis数量增加了2700多倍。30%的粪肠球菌菌株具有编码被称为溶细胞素的外毒素基因。细胞溶素阳性(溶菌酶)粪肠球菌的存在与酒精性肝炎患者的肝病严重程度和死亡率相关:89%的细胞溶素阳性患者在入院后180天内死亡,而细胞溶素阴性患者的这一比例为3.8%。接下来,研究人员使用ALD的小鼠模型证明细胞溶素直接促进疾病进展。细胞溶素会直接在体外诱导肝细胞死亡,并促进酒精性肝病(慢性酒精饮食)小鼠的肝损伤。而小鼠用粪肠球菌定殖后,再喂食乙醇则比对照组存在更严重的肝损伤和肝脂肪变性。在接受细胞溶素阳性酒精性肝炎患者粪便移植的无菌小鼠中也观察到ALD严重程度的相同趋势。研究人员已开发出一种新型治疗方法,即通过使用噬菌体特异性地靶向粪肠球菌。从污水中分离出四种能够从Atp4aS1/S1小鼠粪便中裂解粪肠球菌的噬菌体。灌胃给药这些噬菌体,Atp4aSl/Sl小鼠在长期灌胃乙醇后导致的肝损伤、脂肪变性和炎症比对照噬菌体或赋形剂组更轻。重要的是,根据16S rRNA测序分析,噬菌体干预后粪便中粪肠球菌的丰度降低。根据qPCR分析,细胞溶素水平降低。(Ⅳ)噬菌体可能通过减轻炎症和调节免疫来缓解移植物抗宿主病。移植物抗宿主病(GVHD)是在造血细胞移植后最常见的严重并发症。最近的数据表明,肠道微生物组失衡的程度与结局和死亡率之间存在相关性。肠杆菌属、葡萄球菌科、放线菌门和厚壁菌门与GVHD的发生和严重程度有关。FMT治疗GVHD的初步结果是,缺乏细菌的粪便提取物有效地介导了FMT的有益作用;成功的FMT与尾状病毒数量增加有关,这表明噬菌体可能是负责FMT疗效的微生物群的关键部分。已有研究证明,噬菌体可以保护肠道上皮细胞免受细菌入侵,并通过与上皮细胞相互作用直接抑制炎症。例如,噬菌体可以抑制大肠杆菌在人类嗜中性粒细胞和单核细胞中诱导的活性氧(ROS)产生以及内毒素诱导的ROS产生。噬菌体尾丝蛋白与宿主细胞表面特异性受体结合并附着在细胞表面。不同的噬菌体在宿主细胞表面有不同的受体。LPS是一种常见的噬菌体受体,如T3、T4和T7。LPS是一种重要的细菌因子,可诱导炎症细胞因子产生,其能够破坏内部环境。噬菌体可干扰LPS的释放,诱导单核细胞产生IL-10和IL-1受体拮抗剂来减轻炎症,并能够通过调节树突状细胞、单核细胞和粒细胞的功能,抑制LPS刺激的NF-kappaB通路来调节免疫功能。Miernikiewicz P等人发现,与PBS处理小鼠相比,LPS处理小鼠的白细胞向肺、肝和脾脏的浸润明显增加。LPS结构与其诱导炎症反应的能力有关。噬菌体蛋白gp12与亲水核心的结合会干扰其形成TLR4-MD-2-LPS复合物的功能,从而导致免疫刺激。噬菌体减少炎症介质的产生,这可能会减少GVHD的发展,并在临床上对GVHD具有保护作用。(Ⅴ)噬菌体和特定细菌通过免疫途径影响类风湿性关节炎。类风湿性关节炎(RA)是一种高度遗传的多因素自身免疫性疾病。有研究表明,RA可能与肠道菌群的变化有关,并且肠道微生物可能会作为炎症介质参与RA发育过程中的免疫调节。RA的特征是血清抗体阳性个体中存在抗环瓜氨酸蛋白(CCP)的抗体。RA的遗传性大概为40-60%。诊断为RA患者的一级亲属(FDR)的家族风险显著增加。Mangalea等人通过对RA患者的FDR(有和没有抗CCP抗体)进行肠道噬菌体分析,发现FDR(高RA风险)组的肠道噬菌体富集于靶向拟杆菌科的噬菌体中。CCP+FDR组中链球菌科噬菌体和Lachnospiraceae噬菌体的数量有所增加。噬菌体可将如Lachnospiraceae等细菌作为其目标宿主,并且它们的增殖与CCP+组中Lachnospiraceae等细菌的丰度增加有关。在CCP+FDR组富集的噬菌体携带辅助代谢基因(AMG) PHNP,其编码磷酸二酯酶并调节磷酸盐的降解。Mangalea还发现在CCP+FDR组中富集的噬菌体会携带转移酶簇,例如甘露糖磷酸转移酶(algA、xanB、rfbA、wbpW和PSLB)、甘露糖庚糖转移酶(gmhC、hldE、waaE和rfaE)、GALE(差向异构酶)和glm转氨酶。CCP+FDR组的噬菌体可能通过转移酶影响细菌细胞壁多糖和生物膜的形成,从而参与免疫逃逸。噬菌体还通过其固有的抗炎特性具有免疫调节作用,并可通过易位到多个组织直接调节淋巴细胞。RA患者的肠道噬菌体群落组成会随着免疫系统功能和疾病的变化而波动,这种群落组成有可能作为早期疾病检测的生物标志物。(Ⅵ)噬菌体通过改变肠道细菌组成和代谢影响血糖稳态。1型糖尿病(T1DM)是一种自身免疫系统攻击Langerhans胰岛素产生细胞的疾病。2型糖尿病(T2DM)是一种慢性代谢性疾病,在胰岛素抵抗和胰岛素分泌受损的情况下伴有高血糖。T1DM和T2DM的发展都与肠道微生物组失调有关。拟杆菌丰度在T1DM中增加,而产丁酸的细菌丰度下降。在T2DM中,硫酸盐还原菌和肠杆菌科的丰度增加,而厚壁菌门和产丁酸细菌的丰度下降。肠道微生物组组成的改变会影响微生物组的功能,如糖或支链氨基酸的膜运输增加,外源性或碳水化合物代谢所涉及的酶活性增加以及细胞运动和丁酸合成所涉及的功能降低。这些变化也会影响微生物组的代谢功能,如短链脂肪酸(SCFA)的产生和维生素代谢,并且这些变化与胰岛素抵抗呈负相关。SCFAs与GPR43和GPR41的结合增加了血浆胰高血糖素样肽-1(GLP-1)和肽YY水平,改善了葡萄糖稳态。噬菌体可能通过影响细菌宿主参与糖尿病的发生和发展。例如,前噬菌体激活显著诱导了大肠杆菌生物膜释放淀粉样蛋白。淀粉样蛋白衍生的卷曲纤维可能通过TLR2-MyD88-NF-kB信号通路触发T1DM进展。通过噬菌体促进肠道革兰氏阴性细菌裂解释放LPS,从而引发全身性亚临床炎症,且影响胰岛素敏感性。Zhao G等人观察到了肠道噬菌体随时间的变化,自身免疫之前肠道病毒的变化以及与细菌微生物组特定成分相关的疾病相关病毒噬菌体的变化。该发现认为噬菌体可能会通过改变肠道微生物组的免疫调节引起血糖异常。此外,噬菌体的生物学特性使它们具有调节宿主丰富度的能力,从而通过肠道微生物群落细菌成分之间的一连串正负相互作用来影响细菌群落的结构。当盲肠病毒群从瘦小鼠转移到胖小鼠时,经移植物诱导过的粪便病毒组的转基因变化会导致肥胖小鼠体重波动,且血糖参数恢复正常。将健康瘦供体的粪便微生物群移植到代谢性疾病受试者身上已被证明可以改善外周胰岛素的敏感性,其中65%的受试者在处理后的前6周内葡萄糖损失增加了10%,并且鉴定和检查了可以解释这些差异的噬菌体组。肠道噬菌体诱发疾病的机制如图4所示。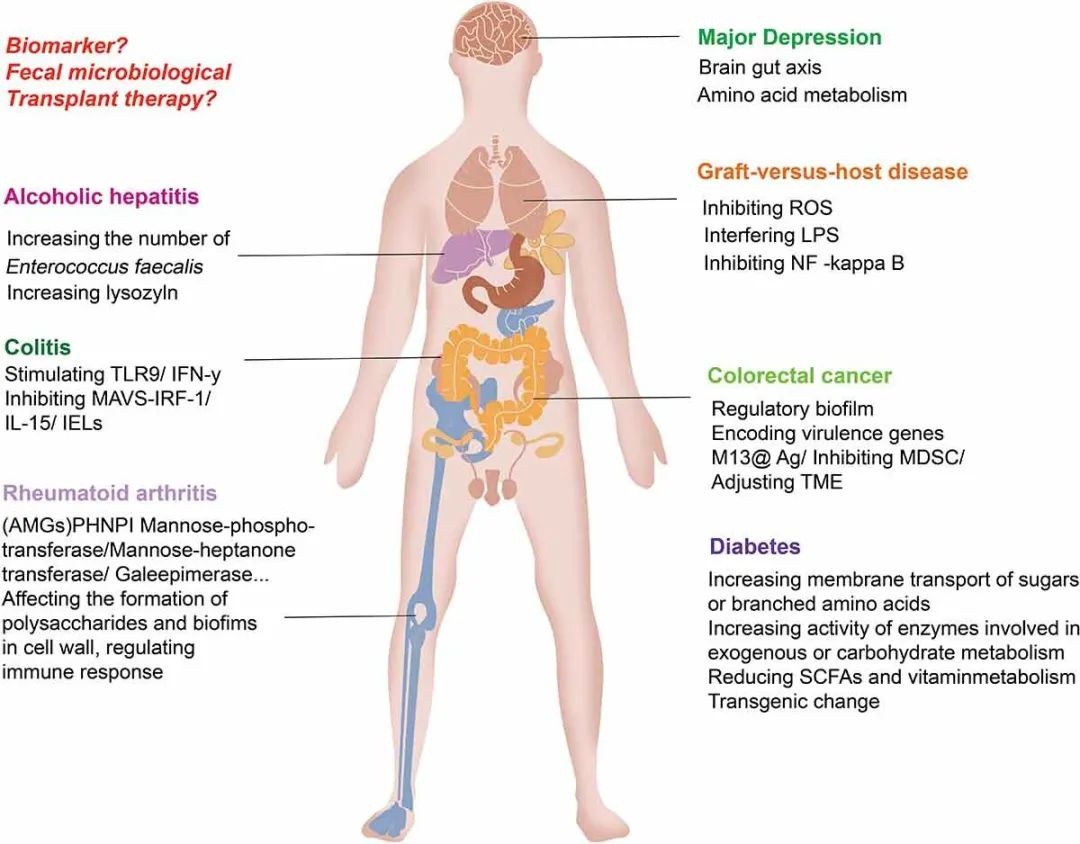
图4 肠道噬菌体通过调节和增加细菌外毒素的释放、调节细菌群落代谢和启动免疫反应来诱导疾病的发展。通过粪便微生物群转移改变肠道噬菌体、细菌及其代谢物可能有助于缓解疾病。与疾病密切相关的细菌代谢物的变化可能被用作疾病监测的标志物。
随着许多对抗生素具有耐受性的细菌的出现,人们对使用噬菌体进行治疗的兴趣逐渐高涨。噬菌体是宿主特异性的,可以靶向特定的致病细菌,且也不会直接影响到宿主中的正常菌群。噬菌体易于生长和纯化;噬菌体是“活药”,会随着目标细菌种群的扩散而增加,可以小剂量给药;噬菌体没有毒性,它们只攻击细菌,不会攻击人体细胞;而且噬菌体具有自限性,一旦目标细菌种群被消除,噬菌体的数量就会大大减少。因此,噬菌体治疗的应用是目前研究的热点。(I)噬菌体鸡尾酒作为抗菌疗法。由于噬菌体是细菌的天敌,近年来抗生素耐药性加强的问题又再次激发了研究者们对噬菌体治疗研究的兴趣。最常见的胃肠道细菌感染是由艰难梭菌引起的腹泻、志贺氏菌引起的痢疾、大肠杆菌引起的胃肠炎、霍乱弧菌引起的霍乱以及肠炎沙门氏菌引起的沙门氏菌病。目前许多研究都已评估噬菌体治疗由大肠杆菌、肠杆菌、霍乱弧菌和艰难梭菌引起的胃肠道感染的潜力。噬菌体疗法已成功为肠道感染、糖尿病足感染、肺部感染、角膜脓肿和其他状况感染的治疗提供了支持。雀巢(瑞士)与孟加拉国达卡医院国际腹泻病研究中心合作,开展了一项I/II期试验以评估急性细菌性腹泻住院儿童口服T4样噬菌体鸡尾酒后的安全性以及有效性,进一步促进了肠道传染病中噬菌体的研究。由于噬菌体个体之间具有协同作用,噬菌体鸡尾酒可能比单种噬菌体更有效。一名患有伴多药耐药鲍曼不动杆菌感染的坏死性胰腺炎的68岁男性在经过多轮抗生素治疗后仍未能得到改善。研究人员从患者身上分离出鲍曼氏菌,并在两个不同的实验室中筛选出了一些噬菌体,混合靶向细菌的噬菌体以产生噬菌体鸡尾酒,并通过腹腔导管和静脉注射施用噬菌体混合物后实现了快速的改善。噬菌体注射通过使用靶向特定细菌的噬菌体,可以成为控制耐药细菌治疗细菌感染的有效方法。(II)噬菌体疫苗增强特异性免疫反应。噬菌体主要由包裹在衣壳中的核酸和蛋白质组成,可保护它们免受核酸酶的降解。由于噬菌体能够在一系列的pH值下维持稳定性并抵抗核酸酶的降解,因此噬菌体是DNA的优良载体。在真核宿主中,噬菌体是惰性颗粒抗原,不能触发发病机制。因此,最近几年来许多研究都在探索以噬菌体作为纳米药物平台来研发疫苗。目前,大多数噬菌体疫苗是噬菌体展示疫苗和噬菌体DNA疫苗。噬菌体展示疫苗将参考外源蛋白或多肽的DNA序列插入噬菌体衣壳蛋白结构基因的适当位置,使外源基因随着外壳蛋白的表达而表达。然后噬菌体使用显示在外壳蛋白表面的抗原结合肽捕获特定分子,例如复制酶、病原体病毒因子或细菌细胞抗原。噬菌体展示技术可用于制备辅助肠道传染病诊断和治疗的抗肠道病原微生物疫苗。噬菌体DNA疫苗是完整的噬菌体颗粒,可用作编码保护性抗原肽的基因载体。噬菌体基因组中CpG序列的比例相对较高,且TLR-9可识别CpG序列并启动免疫应答。DNA纳米装置疫苗由两种分子佐剂和一种抗原肽精确组装而成,已被证实可诱导强大的抗原特异性T细胞反应以产生肿瘤消退和形成长期T细胞反应,以保护身体免受肿瘤复发。噬菌体DNA疫苗靶向肠道肿瘤,在改善肠道微环境的同时会启动适应性免疫,是值得进一步探索的潜在治疗方法。(III)噬菌体模块交换或基因编辑。细菌是人类健康和疾病状况的核心,但现有的编辑微生物群的工具有限。例如,广谱抗生素不能精确控制细菌群落。合成生物学正开始解决这个问题;微生物合成生物学是指一种特定的生物应用系统,它可以修改微生物的内部结构,从而模仿特定工程系统的功能。利用合成生物学来编辑噬菌体可以扩大其宿主范围,增强噬菌体穿透生物膜的能力,提高噬菌体在抗菌治疗中的靶向使用。Ando H等人将大肠杆菌噬菌体支架指向致病性Yersinia和Klebsiella;相比之下,克雷伯氏菌噬菌体支架通过噬菌体尾部组件的模块交换被引导到大肠杆菌。合成噬菌体可以有效地杀死目标细菌,并使用基于普通病毒支架的混合物选择性地从多种细菌群落中去除特定细菌。由CRISPR/Cas系统修饰的噬菌体可以通过消除耐药质粒使耐药细菌致敏。麻省理工学院的合成生物学家Timothy Lu及其团队使用DNA编程CRISPR技术构建了特异性感染和杀死耐药细菌的工程噬菌体。噬菌体通过RNA片段靶向攻击具有耐药DNA序列的细菌。如果细菌含有耐药DNA序列,RNA可以与该序列结合并与Cas9酶结合以切割细菌DNA并杀死细菌。Jalasvuori等人表明,对大肠杆菌和肠炎沙门氏菌使用质粒依赖性噬菌体可显著减少耐药细菌的数量。噬菌体是替代抗生素控制感染性细菌的潜在候选物。然而,宿主细菌对噬菌体的抗性是不可避免的。有趣的是,对噬菌体耐药性做出反应的肠道细菌恢复了对某些抗生素的敏感性。铜绿假单胞菌具有多药外排系统MexAB和MexXY的外膜孔蛋白M(OprM)这一受体结合位点。Chan BK等人发现,铜绿假单胞菌对噬菌体攻击的耐药性的进化改变了外排泵机制,导致对环丙沙星和四环素等抗生素药物的敏感性增加。Fong K等人发现,对四环素的敏感性增加,而肠道链球菌通过参与VI型分泌的突变基因对噬菌体SI1产生耐药性,这有助于LPS的产生。(Ⅳ)噬菌体靶向递送肠道疾病治疗药物。噬菌体可以被工程化以形成具有亲和性的自组装纳米材料。附着在噬菌体表面的药物可以由噬菌体携带到体内的特定位置。然后,携带药物的噬菌体可以通过特异性溶解细菌、释放药物或结合特定癌细胞膜上的抗体受体、参与内吞作用或治疗细胞内降解来改善疾病环境。研究还发现,口服噬菌体引导的伊立替康纳米颗粒不会引起仔猪血细胞计数、免疫球蛋白和组胺水平或肝肾功能的显著变化。这种病毒颗粒共价修饰技术的出现为病毒衣壳转化为靶向药物载体系统奠定了基础。Kovacs等人能够用聚乙二醇(PEG)链包覆无基因组的MS2衣壳,并将50-70个荧光药物模拟物结合到衣壳中。研究表明,尽管进行了广泛的修饰,但衣壳仍保持组装状态,使其成为药物的有效递送容器。药物也可以附着在噬菌体表面,而不损害细胞靶点。例如,载药脂质体可以通过噬菌体-脂质体复合物向细胞递送药物。天然存在于肠道中的噬菌体载体药物具有靶向性好、治疗效果强、毒副作用小的特点,有望成为理想的给药工具。噬菌体在肠道疾病治疗中的应用如图5所示。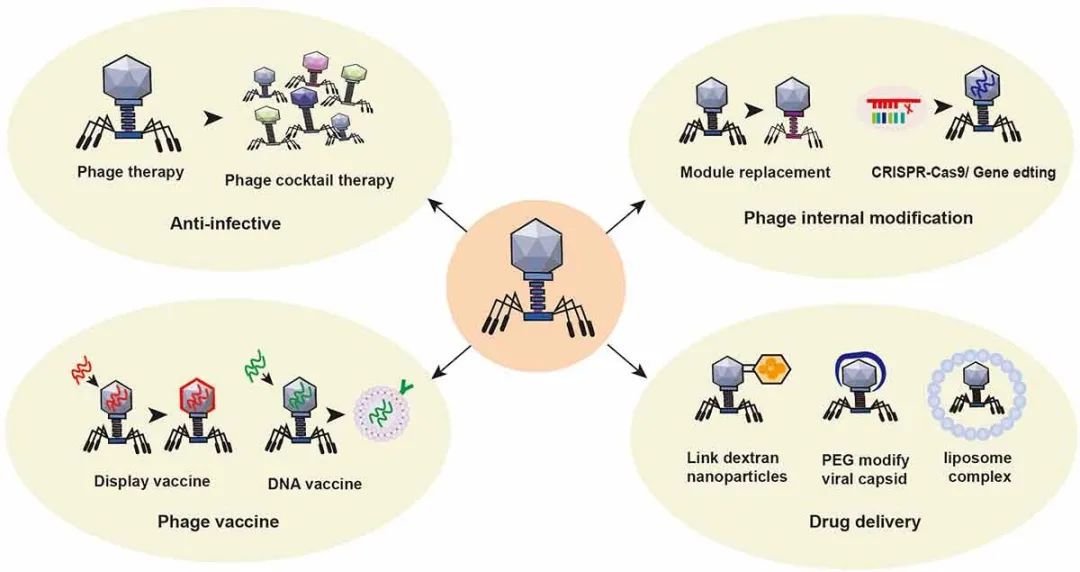
图5 噬菌体在肠道疾病治疗中的应用。①利用噬菌体的特性,制备一种噬菌体鸡尾酒用于靶向细菌感染。②噬菌体的结构可以通过切换噬菌体模块或通过应用CRISPR基因编辑技术来改变肠道细菌宿主或增强其对肠道细菌宿主的拮抗性来改变。③制备噬菌体展示疫苗和噬菌体DNA疫苗以增强特异性免疫反应。④使用噬菌体以靶向递送疾病治疗药物来治疗特定的肠道或其他细菌。例如,葡聚糖纳米颗粒共价连接到叠氮化物修饰的噬菌体、聚乙二醇衣壳修饰的噬菌体、噬菌体-脂质体复合物和其他抗结直肠癌药物。
(Ⅴ)噬菌体疗法的潜在局限性。并非所有噬菌体都适合于治疗用途。裂解噬菌体通常用于临床治疗。要求具有特定的裂解特性和稳定的裂解效应(不受温度和环境影响),并确保安全高效(基因组中没有毒素蛋白基因)。噬菌体制剂可能含有宿主细菌的内毒素蛋白,溶解宿主后释放的细菌内毒素可能会影响机体的正常功能。不能快速溶解细菌的噬菌体对细菌的抵抗力较弱。噬菌体通常只作用于特定的细菌属或种类,有些甚至只作用于一个种类的有限数量的菌株。临床上噬菌体制剂主要包括噬菌体核酸、衣壳蛋白等。这些制剂比具有单一化学结构的常见临床药物制剂更为复杂。很难评估药物的活性和纯度,无法准确定义噬菌体制剂的给药方法、剂型、剂量、浓度和给药时间。噬菌体制剂的药代动力学尚不清楚,无法评估噬菌体进入人体后的安全性。目前尚不清楚噬菌体的使用是否也会对人体免疫系统产生不利影响。
原文链接:https://www.tandfonline.com/doi/full/10.1080/19490976.2022.2113717
免责声明:本文仅代表作者个人观点,与中国益生菌网无关。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
版权声明
1.本站部分转载的文章非原创,其版权和文责属于原作者。2.本网所有转载文章、链接及图片系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,对可以提供充分证据的侵权信息,bio149将在确认后12小时内删除。3.欢迎用户投递原创文章至86371366@qq.com,经审核后发布到首页,其版权和文责属于投递者。