GUT(IF:31.7): 肠道菌群通过PUFA相关神经炎症调节阿尔茨海默病的病理和认知障碍
时间:2023-02-07 来源:《微生态》公众号 作者:微科盟煎蛋 浏览次数:2157导读
本研究旨在调查肠道生态失调在大脑炎症中的作用及其对阿尔茨海默病(AD)发病机制的贡献。本研究以年龄依赖性方式分析了3×Tg小鼠的肠道微生物群组成。生成了无菌3×Tg小鼠,并使用AD患者和年龄匹配的健康供体粪便样本对无菌3×Tg小鼠进行了再定植。微生物16S rRNA测序显示拟杆菌富集。与SPF小鼠相比,GF 3×Tg小鼠的大脑淀粉样蛋白β斑块和神经原纤维缠结病理明显减少。海马RNAseq显示,在没有肠道微生物群的情况下,3×Tg小鼠大脑中的炎症通路和胰岛素/IGF-1信号通路发生异常改变。代谢组学分析鉴定出多不饱和脂肪酸代谢产物及其氧化酶选择性升高,对应小胶质细胞活化和炎症。与健康供体的微生物群移植相比,AD患者的肠道微生物组加剧了3×Tg小鼠的AD病理,与C/EBPβ/AEP途径激活和认知功能障碍相关。综上所述,这些结果支持复杂的肠道微生物组是行为缺陷、小胶质细胞活化和AD病理所必需的,肠道微生物组有助于AD小鼠模型的病理,人类微生物组的生态失调可能是AD的风险因素。
论文ID
原名:Gut microbiota regulate Alzheimer's disease pathologies and cognitive disorders via PUFA-associated neuroinflammation
译名:肠道菌群通过PUFA相关神经炎症调节阿尔茨海默病的病理和认知障碍
期刊:Gut
IF:31.793
发表时间:2022.11
通讯作者:叶克强
通讯作者单位:美国埃默里大学医学院
DOI号:10.1136/gutjnl-2021-326269
实验设计
结果
1 肠道微生物刺激了3×Tg小鼠的AD病理、认知缺陷和小胶质细胞活化
作者最近报道了老龄3×Tg小鼠的微生物群通过激活大脑中C/EBPβ/AEP信号通路加速了年轻3×Tg小鼠的AD病理,表明年龄依赖性微生物组的变化会影响AD病理。因此,微生物组组成的纵向研究对于发现影响宿主的微生物群落的变化是必要的。为了鉴定微生物群中促进AD小鼠模型中生理或病理生理反应的时间特征,我们利用3×Tg AD小鼠模型通过高通量测序分析生成了17个月的16S rRNA基因谱的时间序列。微生物组分析显示,4、8、12和17月龄3×Tg小鼠的微生物组成存在显著不平衡。此外,主坐标(PCoA)分析表明,3×Tg小鼠的微生物群与年轻野生型小鼠的微生物群明显聚集。在门水平上,与4月龄WT相比,4、12和17月龄3×Tg小鼠中变形菌门的相对丰度增加。另一方面,厚壁菌门和蓝藻的相对丰度逐渐降低,而8月龄和17月龄3×Tg小鼠中拟杆菌门的相对丰度则显著高于4月龄3×Tg小鼠。厚壁菌门的减少和拟杆菌门的增加与炎症和不同疾病有关。此外,粘蛋白降解和诱导炎症的瘤胃球菌物种在老龄3×Tg小鼠中的相对频率增加。简而言之,微生物组分析表明,老龄3×Tg小鼠体内的微生物群发生了改变,其特征是有益抗炎细菌群落减少,随后肠道促炎致病菌富集。
为了阐明肠道微生物群在AD发病机制中的作用,我们将GF重新衍生为3×Tg AD小鼠模型。平均而言,GF小鼠体重比同龄SPF小鼠轻。此外,由于肠道微生物组缺失,GF小鼠表现出盲肠增大,体重增加,盲肠内容物呈深色,尽管它们的胃肠道长度仍与SPF小鼠相当。GF小鼠粪便样本的无菌状态通过细菌培养物进一步验证,细菌培养物未显示可证明的细菌。与SPF 3×Tg小鼠相比,GF小鼠皮层中Aβ聚集物沉积和ThS(硫黄素S)免疫荧光(IF)共染色信号显著降低。此外,与SPF小鼠相比,用特异性T22单克隆抗体验证的海马过度磷酸化tau(AT8)和纤维tau包涵体也显著减少(图1A,B)。定量显示,与SPF小鼠相比,GF小鼠中的Aβ42(而非Aβ40)减少(图1C)。这些观察结果表明,当肠道微生物群耗尽时,AD病理得到缓解。
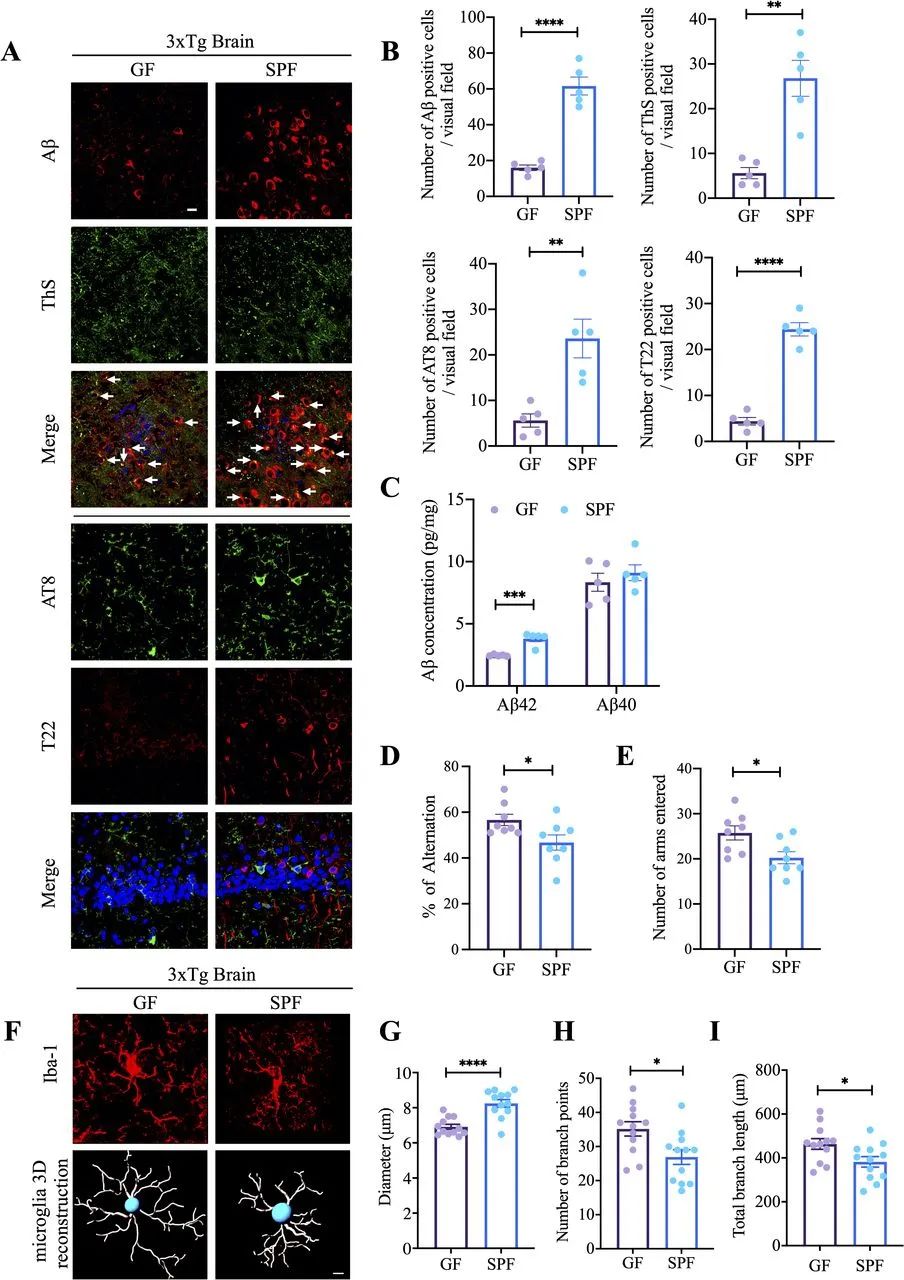
图1 与SPF 3×Tg小鼠相比,GF 3×Tg小鼠表现出更少的AD病理和更好的认知功能。(A) GF 3×Tg小鼠和SPF小鼠大脑额叶皮层区的Aβ(红色)和ThS(绿色),海马CA1区的AT8(绿色)和T22(红色)的免疫荧光染色。比例尺:20 μm。(B)定量分析显示SPF小鼠脑中Aβ、ThS、AT8和T22阳性细胞的密度显著增加。(C)使用人Aβ40和Aβ42 ELISA试剂盒检测GF 3×Tg小鼠和SPF 3×Tg小鼠皮层中Aβ40和Aβ42的浓度。SPF 3×Tg小鼠皮层中Aβ42含量明显高于GF 3×Tg小鼠。(D、E) Y迷宫行为测试。自发交替(%)(D),进入臂次数(E)。(F) GF 3×Tg小鼠和SPF 3×Tg小鼠皮层中Iba-1(红色)免疫荧光染色的代表性图像(上图)和Iba-1染色小胶质细胞的3D重建(下图)。(G-I)定量分析位于皮层中的小胶质细胞的直径、分支点数和总分支长度。Aβ,淀粉样蛋白-β;GF,无菌;SPF,无特定病原体。
2 肠道微生物激活C/EBPβ/AEP途径,升高与PUFA代谢有关的促炎酶
我们最近的研究支持C/EBPβ/AEP信号通路在时空上调控AD病理。为了评估是否需要完整的肠道微生物组来刺激这一途径,从而促进AD的发病,我们进行了免疫印迹分析,发现与SFP小鼠相比,GF 3×Tg小鼠大脑中的C/EBPβ/AEP信号减弱。随后,AEP截短的tau N368和APP N585片段减少,与p-tau AT8和AT100活性降低相关。值得注意的是,与SPF小鼠相比,GF 3×Tg小鼠的Lox5,Cox1和Cox2水平明显降低(图2A,B),这与先前的研究结果相吻合,即AA代谢途径不仅是炎症的核心网络,也是工作记忆障碍导致AD发病的主要原因。正如预期的那样,蛋白酶检测显示GF小鼠的AEP酶活性低于SPF小鼠,与活性AEP水平降低一致(图2C)。由于C/EBPβ是IL-6的主要转录因子,因此,与SPF小鼠相比,GF小鼠中的IL-6浓度显著降低(图2D)。qRT-PCR结果显示,与SPF小鼠相比,GF小鼠的CEBPβ靶标/AA通路基因略有降低(图2E),与RNAseq数据相对应。然而,qRT-PCR数据没有统计学意义,这可能是由于定量PCR(qPCR)分析的差异较大所致。
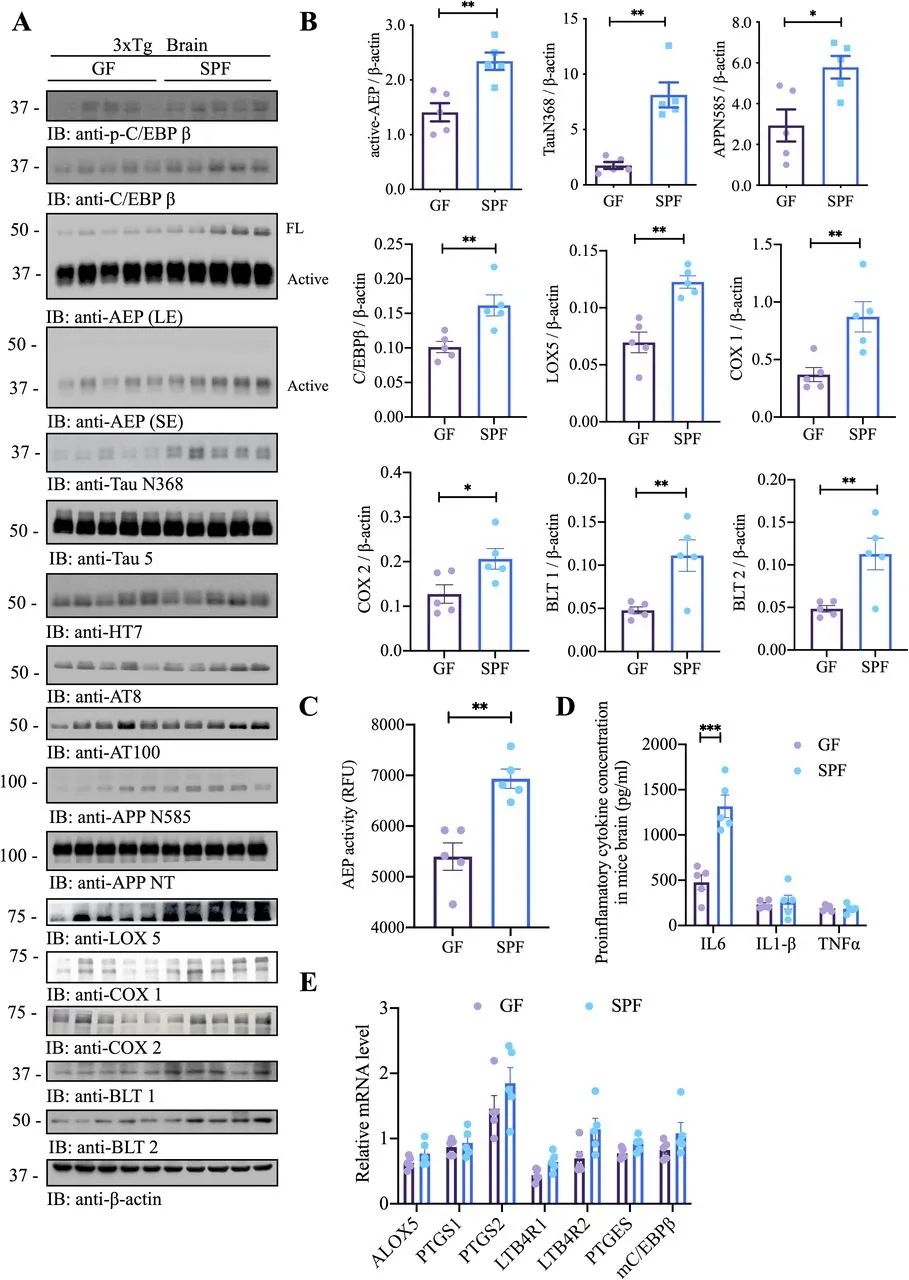
图2 GF 3×Tg小鼠C/EBPβ/AEP通路减弱和AA相关炎症减弱。(A)免疫印迹显示GF 3×Tg小鼠和SPF 3×Tg小鼠大脑中的p-C/EBPβ、C/EBPβ、AEP、APP和tau蛋白表达、加工以及花生四烯酸代谢。(B)免疫印迹定量分析。用image J统计活性AEP、TauN368、APPN585、C/EBPβ、LOX5、Cox1、COX2、BLT1和BLT2的条带,并用β-肌动蛋白归一化。(C) GF 3×Tg小鼠和SPF 3×Tg小鼠脑裂解物中AEP活性测定。与GF 3×Tg小鼠相比,SPF 3×Tg小鼠的AEP活性升高。(D) GF 3×Tg小鼠和SPF 3×Tg小鼠脑裂解物中促炎细胞因子IL1-β、IL-6和TNFα的浓度。(E)对GF小鼠与SPF小鼠的脑样本进行定量RT-PCR分析,比较C/EBPb靶向AA通路基因。AA,花生四烯酸;AEP,天冬酰胺内肽酶;COX,环氧酶;SPF,无特定病原体。
3 肠道菌群提高炎症代谢物并改变大脑中的炎症和胰岛素/IGF-1通路
为了评估肠道微生物组对AD相关转录反应的整体影响,我们使用GF和SPF 3×Tg小鼠的海马样本进行了无偏RNA测序,并通过RNA转录本的定量深度测序测量了全基因组mRNA表达谱(图3)。我们发现SPF和GF动物之间的mRNA谱和整体基因表达模式存在显著差异。通过主成分分析(PCA)对数据集中的主要方差来源进行评估,显示GF和SPF 3×Tg小鼠之间明显分离(图3A)。我们观察到SPF 3×Tg小鼠与GF 3×Tg小鼠的1872个差异基因(图3B)。在差异表达基因中,与GF 3×Tg小鼠相比,我们在SPF 3×Tg小鼠的海马中观察到载脂蛋白E的表达下调。接下来,利用GF和SPF 3×Tg小鼠之间海马区差异表达基因,通过功能mRNA的聚类分析生成热图(图3C)。值得注意的是,与GF 3×Tg小鼠相比,参与AA代谢途径的基因,包括Hpgd、Ptges3、Ptges2和Cyp1b1,在SPF 3×Tg小鼠中差异表达(上调:Hpgd、Ptges3和Cyp1b1;下调:Ptges2)(图3D),这与我们的观察结果相吻合,许多AA相关炎症酶在GF小鼠中明显减少。有趣的是,除了AA代谢途径中显著改变的促炎基因外,RNAseq还显示,与GF小鼠相比,SPF小鼠的胰岛素信号及其相关的下游通路发生了异常改变(图3E)。因此,我们通过免疫印迹检测海马胰岛素信号,发现与SPF小鼠相比,GF小鼠的p-胰岛素受体(IR)和p-IRS(IR底物)及其下游效应物(包括p-Akt和p-MAPK和p-GSK活性)均显著增加(图3F)。这些数据与先前的报道一致,即AD患者表现出进行性脑胰岛素抵抗和胰岛素缺乏。
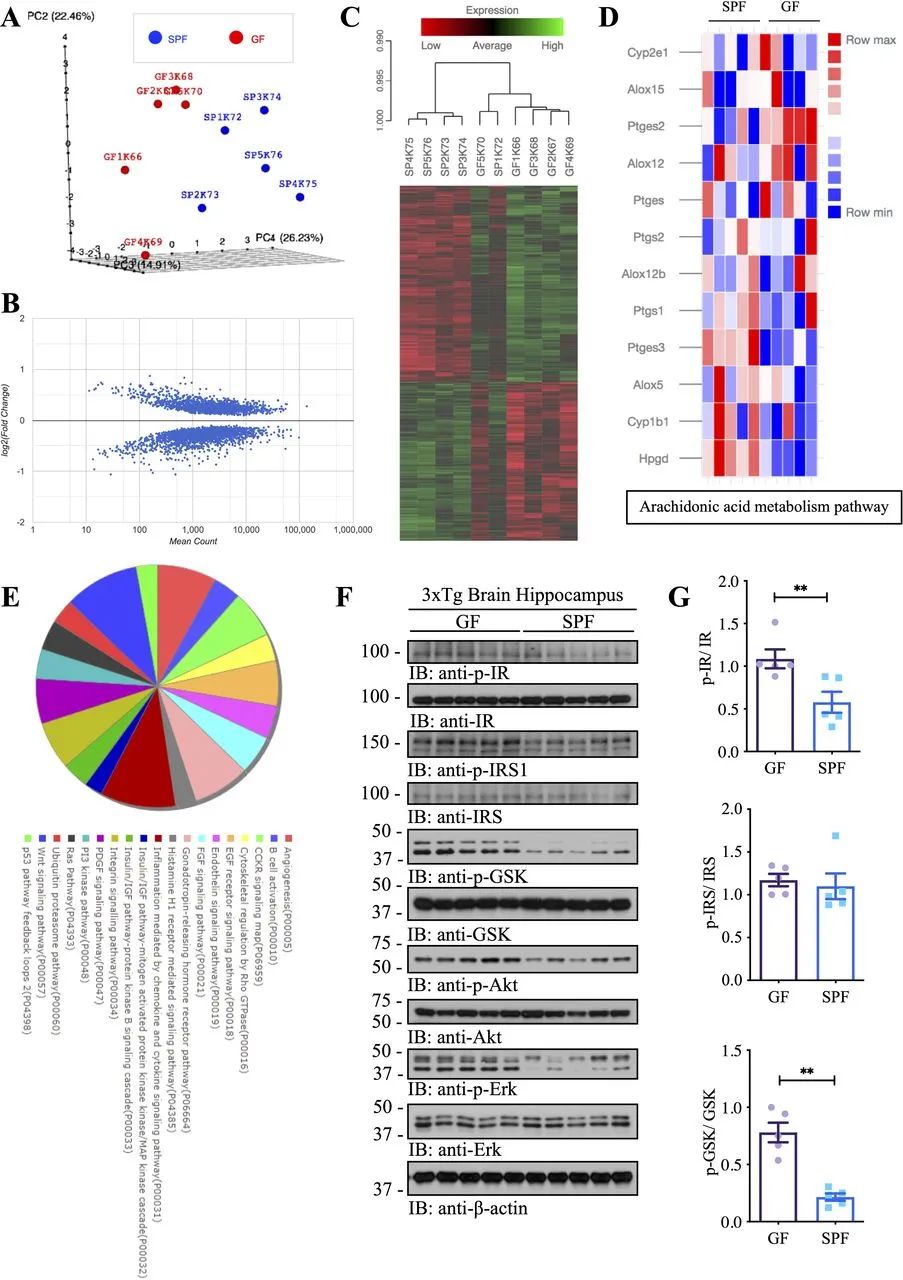
图3 肠道菌群影响GF和SPF 3×Tg小鼠AD模型海马区mRNA表达的转录组谱。(A)主成分分析(PCA)中显示样品间距离的图。(B)散点图显示log2(倍数变化)与归一化平均基因计数的关系。(C) GF和SPF中功能性mRNA的聚类分析,数据以热图形式呈现(p<0.05)。每行代表所有小鼠中单个基因的相对表达水平;每列表示单个小鼠的表达级别。红色和绿色分别表示低表达和高表达。(D)热图显示了GF和SPF之间花生四烯酸代谢途径的差异基因。(E)差异基因的KEGG和Panther通路分析。(F)免疫印迹显示GF 3×Tg小鼠和SPF 3×Tg小鼠海马中胰岛素/IGF-1信号通路。(G)免疫印迹定量分析。p-IR、p-IRS和p-GSK的条带分别用image J测量,并分别用IR、IRS和GSK归一化。AD,阿尔茨海默病;GF,无菌;IR,胰岛素受体;SPF,无特定病原体。
4 短链脂肪酸触发GF 3×Tg小鼠的C/EBPβ/AEP激活和认知缺陷以及被前列腺素E2-1-甘油酯加剧的炎症
AD患者的肠道微生物群具有较低比例的关键产丁酸盐菌,例如Butyrivibrio和Eubacterium属的成员。老年AD的丁酸盐酶编码基因也比没有痴呆的健康老人低。较低比例的产丁酸盐菌会导致促炎状态。事实上,AD患者粪便移植的ex-GF小鼠的粪便和血清中的短链脂肪酸(SCFAs)降低。为了研究SCFAs是否会部分模拟定植SPF小鼠的肠道微生物群,从而触发C/EBPβ/AEP通路激活,我们连续3个月给GF 3×Tg小鼠喂食对照或乙酸盐、丙酸盐和丁酸盐混合的SCFAs(同时动物保持微生物无菌状态)。免疫印迹显示,饲喂SCFAs的GF小鼠中p-C/EBPβ及其总蛋白水平升高;下游AEP及其活性形式增加,从而触发Tau N368和APP N585表达增强。随后,p-Tau AT8活性也相应增加。结果,与对照相比,SCFAs喂养增强了C/EBPβ的下游靶点,包括Lox-5、Cox1、Cox2、BLT1和BLT2水平(图4A)。定量酶检测证实,与对照相比,SCFAs喂养的GF小鼠中AEP蛋白酶活性显著增强(图4B)。与C/EBPβ激活一致,下游反应性炎症细胞因子IL-6增加(图4C)。Aβ ELISA定量显示,SCFAs处理显著增加了大脑中Aβ42的浓度,但Aβ40的浓度没有显著提高(图4D)。这些结果被IF染色进一步证实。在海马中,SCFAs增强了ThS阳性Aβ聚集物、p-Tau AT8和原纤维Tau T22信号(图4E,F)。此外,与AEP截短Tau N368和APP C586片段相关的AEP升高也在SCFAs处理中富集。与SCFAs在GF 3×Tg小鼠中产生的AD病理一致,认知行为实验发现,尽管进入臂的数量保持不变,但SCFAs喂养的GF小鼠转换百分比被显著抑制(图4G,H)。小胶质细胞是大脑中的常驻巨噬细胞,可保护中枢神经系统免受损伤和感染。小胶质细胞还通过调节突触传递、突触形成和修剪以及胚胎脑布线的各个方面促进整个胚胎期和成年期的大脑发育。在受影响的海马和皮层区域,与对照处理的GF小鼠相比,SCFAs处理的GF小鼠中小胶质细胞表现出活化和成熟增加的形态,分别与GF和SPF小鼠的小胶质细胞相似(图4J)。
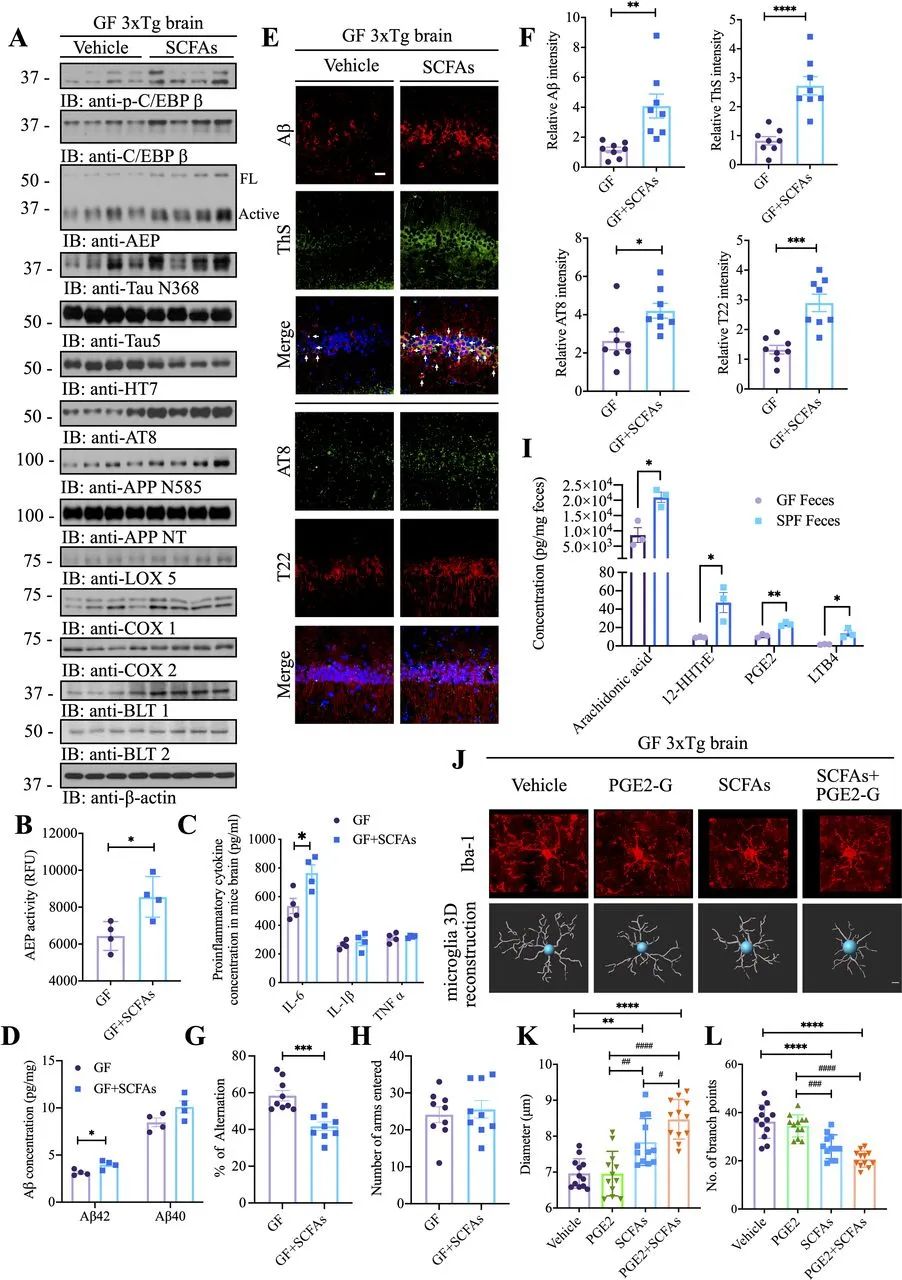
图4 SCFAs触发GF 3×Tg小鼠的C/EBPβ/AEP激活和认知缺陷以及被PGE2-G加剧的炎症。(A)免疫印迹显示有/无SCFAs处理的GF小鼠大脑中p-C/EBPβ、C/EBPβ、AEP、APP和tau蛋白表达和加工,以及花生四烯酸代谢。(B)有/无SCFAs处理的GF 3×Tg小鼠脑裂解物中的AEP活性测定。SCFAs处理可提高GF 3×Tg小鼠大脑中的AEP活性。(C) GF 3×Tg小鼠和SPF 3×Tg小鼠脑裂解物中的促炎细胞因子IL1-β、IL-6和TNFα浓度。(D)使用人Aβ40和Aβ42 ELISA试剂盒检测GF 3×Tg小鼠皮层中Aβ40和Aβ42的浓度。与对照处理的GF 3×Tg小鼠相比,SCFAs处理的GF 3×Tg小鼠的大脑皮层中Aβ42的浓度显著增加。(E)有/无SCFAs处理的GF 3×Tg小鼠大脑海马CA1区Aβ(红色)和ThS(绿色)、AT8(绿色)和T22(红色)的免疫荧光染色。比例尺:20 μm。(F)定量分析Aβ阳性细胞、ThS阳性细胞、AT8阳性细胞和T22阳性细胞。在SCFAs处理的GF 3×Tg小鼠大脑中,Aβ、ThS、AT8和T22阳性细胞的密度显著增加。(G,H) Y迷宫行为测试。自发交替(G),进入臂次数(H)。(I) GF小鼠和SPF小鼠粪便中花生四烯酸及其代谢物的浓度。(J) GF 3×Tg小鼠、PGE2-G或SCFAs处理GF 3×Tg小鼠、以及SCFAs和PGE2-G处理GF 3×Tg小鼠皮层中Iba-1染色小胶质细胞(红色)的代表性图像(上图)和3D重建(下图)。(K,L)定量分析驻留在皮层中小胶质细胞的直径和分支点数量。Aβ,淀粉样蛋白-β;AEP,天冬酰胺内肽酶;GF,无菌;PGE2-G,前列腺素E2-1-甘油酯;SCFA,短链脂肪酸。
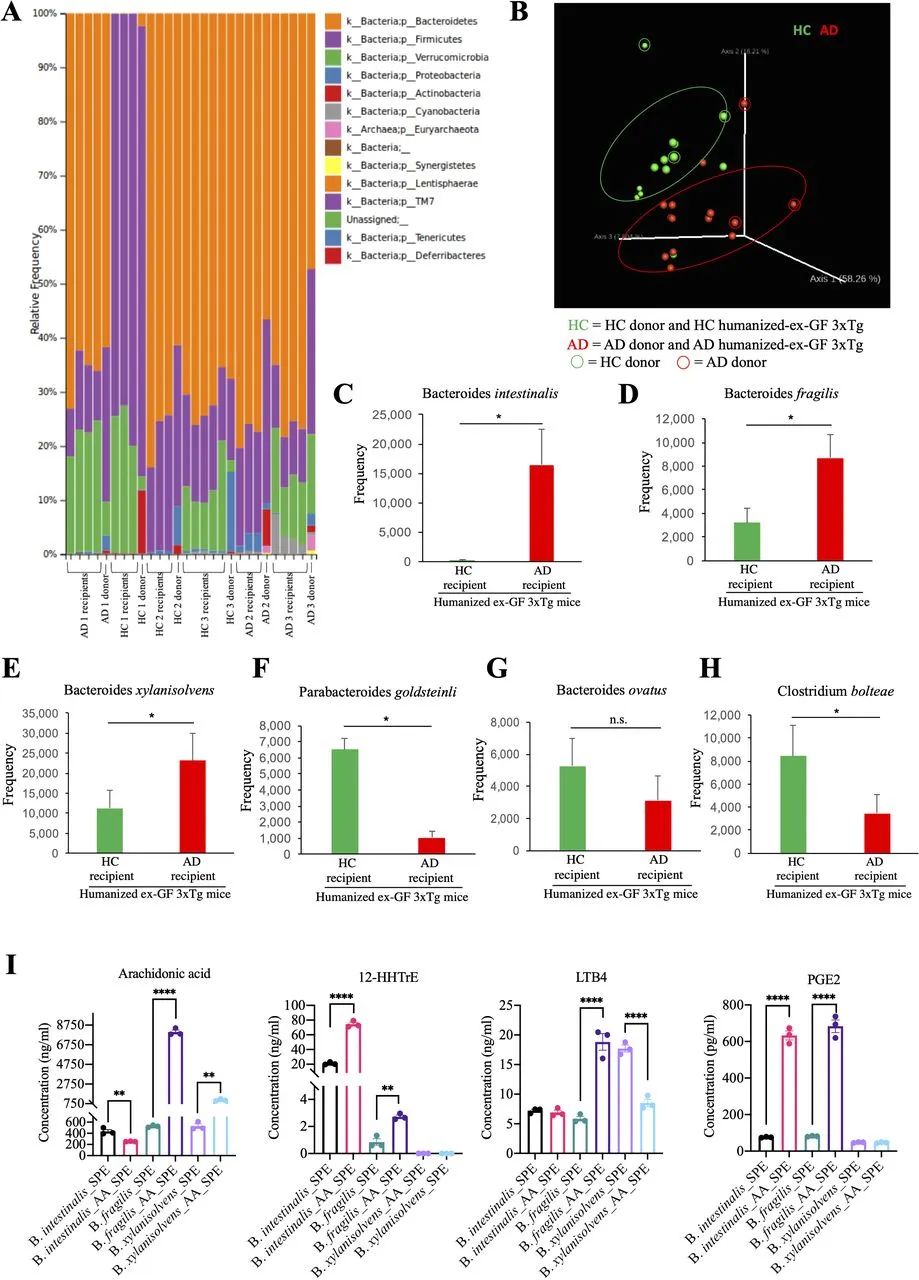
图5 对人源化GF 3×Tg小鼠粪便进行微生物组分析,发现AD患者粪便菌群接种GF小鼠后,粪便中的拟杆菌增多。(A)通过高通量测序分析确定细菌门的相对丰度。(B)微生物群落结构的主坐标图(PcoA)。(C-H)细菌种类的平均频率。(I) Bacteroides intestinalis、Bacteroides fragilis和Bacteroides xylanisolvens体外培养物中花生四烯酸(AA)及其代谢物的浓度。AD,阿尔茨海默病;ANOVA,方差分析。
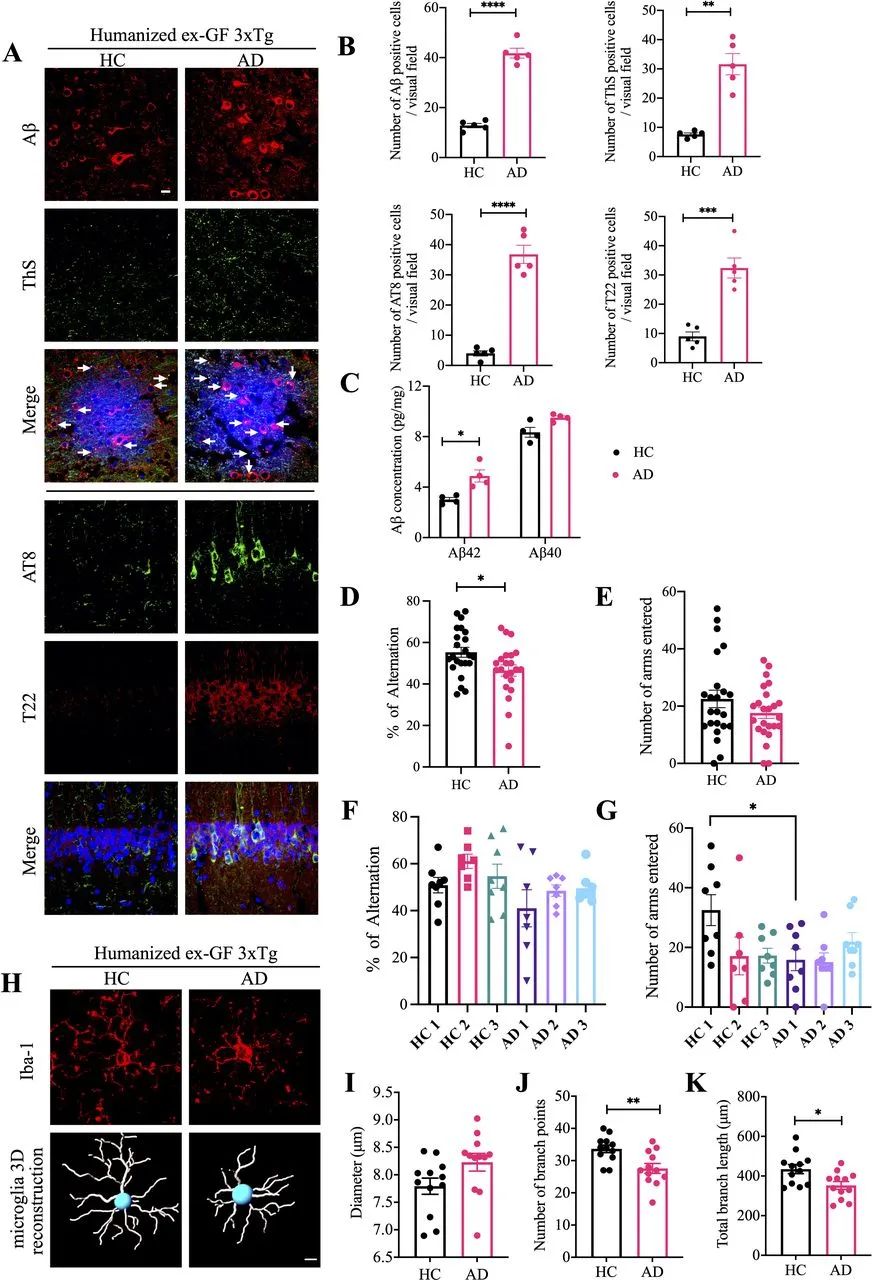
图6 AD粪便人源化GF小鼠表现出增强的AD病理和认知缺陷。(A) HC人源化ex-GF 3×Tg小鼠和AD人源化ex-GF 3×Tg小鼠的大脑额叶皮层区域的Aβ(红色)和ThS(绿色)的免疫荧光染色,大脑海马CA1区的AT8(绿色)和T22(红色)的免疫荧光染色。HC,GF小鼠定植HC的粪便微生物组;AD,GF小鼠定植AD患者的粪便微生物组。比例尺:2 μm。(B)定量分析Aβ阳性细胞、ThS阳性细胞、AT8阳性细胞和T22阳性细胞。Aβ、ThS、AT8和T22阳性细胞的密度在AD人源化ex-GF 3×Tg小鼠脑中显著增加。(C)使用人Aβ40和Aβ42 ELISA试剂盒检测HC人源化ex-GF 3×Tg小鼠和AD人源化ex-GF 3×Tg小鼠皮层中Aβ40和Aβ42的浓度。与HC人源化ex-GF 3×Tg小鼠相比,AD人源化ex-GF 3×Tg小鼠皮层中Aβ42的含量显著增加。(D-G) Y迷宫行为测试。(D-E)每个Y迷宫测试中所有独立队列的汇编:自发交替(%),进入臂次数,按粪便供体的健康状态分组;(F-G)自发交替(%)。(H) HC人源化ex-GF 3×Tg小鼠和AD人源化ex-GF 3×Tg小鼠皮层中Iba-1(红色)免疫荧光染色的代表性图像(上图)和Iba-1染色小胶质细胞的3D重建(下图)。(I-K)对驻留在皮层的小胶质细胞的直径、分支点数和总分支长度进行定量分析。Aβ,淀粉样蛋白-β;AD,阿尔茨海默病;HC,健康对照。
为了深入表征人源化ex-GF 3×Tg小鼠的病理特征,我们进行了免疫印迹,发现与HC相比,人类AD微生物组移植后p-C/EBPβ及其总蛋白水平显著升高。下游AEP及其成熟形态也随上游转录因子活性改变。因此,Tau N368、APP N585以及p-Tau AT8信号明显升高。同样,下游响应基因包括Lox-5、Cox1、Cox2、BLT1和BLT2水平均与上游C/EBPβ信号相呼应(图7A,B)。正如预期的那样,AEP酶活性得到了适当的增强(图7C)。炎性细胞因子的定量结果显示,AD患者粪便移植后IL-6和IL-1β显著增加(图7D)。qRT-PCR表明,ALOX-5 mRNA浓度高于其他AA代谢相关基因(图7E),表明ALOX5启动子可能对上游转录因子C/EBPβ活性更加敏感。这些结果与AD微生物接种GF小鼠中AA代谢物增强的观察结果相一致。
PCA分析表明,HC和AD人源化ex-GF以及GF和SPF组之间存在一些代谢差异。值得注意的是,与HC人源化ex-GF小鼠相比,AD人源化ex-GF小鼠的粪便和血清样本的代谢组学谱显著不同。虽然与GF小鼠相比,SPF小鼠大脑的代谢谱存在显著差异,但HC人源化ex-GF小鼠与AD人源化ex-GF小鼠的大脑代谢差异似乎很小。在粪便数据集中,与HC人源化ex-GF组相比,AD组的几种芳香族代谢物显著更高或呈更高趋势(不显著),而次级胆汁酸、维生素和苯甲酸盐代谢物(如苯甲酸盐)显著改变或有改变趋势(不显著)。在血清中,与HC人源化ex-GF组相比,AD组的几种芳香族氨基酸代谢物(如苯丙酮酸、多巴胺3-O-硫酸盐和3-吲哚基硫酸盐)和次级胆汁酸(如牛磺脱氧胆酸)、维生素(如吡哆醛)和苯甲酸盐代谢物显著升高。此外,在大脑中,与HC人源化ex-GF组相比,AD组中多巴胺呈下降趋势,而苯甲酸盐代谢物马尿酸盐和儿茶酚硫酸酯显著升高或呈上升趋势。在AD人源化ex-GF组的粪便中,几种戊糖代谢物显著升高。在血清中,糖酵解代谢物丙酮酸显著较高,而当将AD与HC人源化ex-GF组进行比较时,戊糖、TCA循环和NAD代谢物显示出与粪便相似的结果。在AD人源化ex-GF组中,TCA能量代谢物乌头酸和苹果酸显著升高。对于脂质代谢,AD人源化GF组粪便中的磷脂酰乙醇胺(PE)代谢物和1-硬脂酰-2-亚油酰基-GPE较高。在AD人源化ex-GF组中,血清中的几种LCFAs(长链脂肪酸)以及几种肉碱结合脂肪酸显著降低。值得注意的是,粪便和血清中的SCFAs,尤其是丁酸盐减少。与HC人源化ex-GF小鼠相比,AD人源化ex-GF组的鞘磷脂相关代谢物明显更高。血清和脑中AA相关代谢物,如血栓素B2,PGF2α和12-HHTrE等升高,但不显著。这些数据表明,与HC人源化ex-GF组相比,AD人源化ex-GF组的脂质代谢发生了显著变化。精氨酸在细胞代谢、炎症信号传导和能量代谢多个方面发挥作用。AD患者的精氨酸代谢改变。在粪便、血清和大脑数据集中,与HC组相比,AD人源化ex-GF组的几种精氨酸代谢物显著更高。
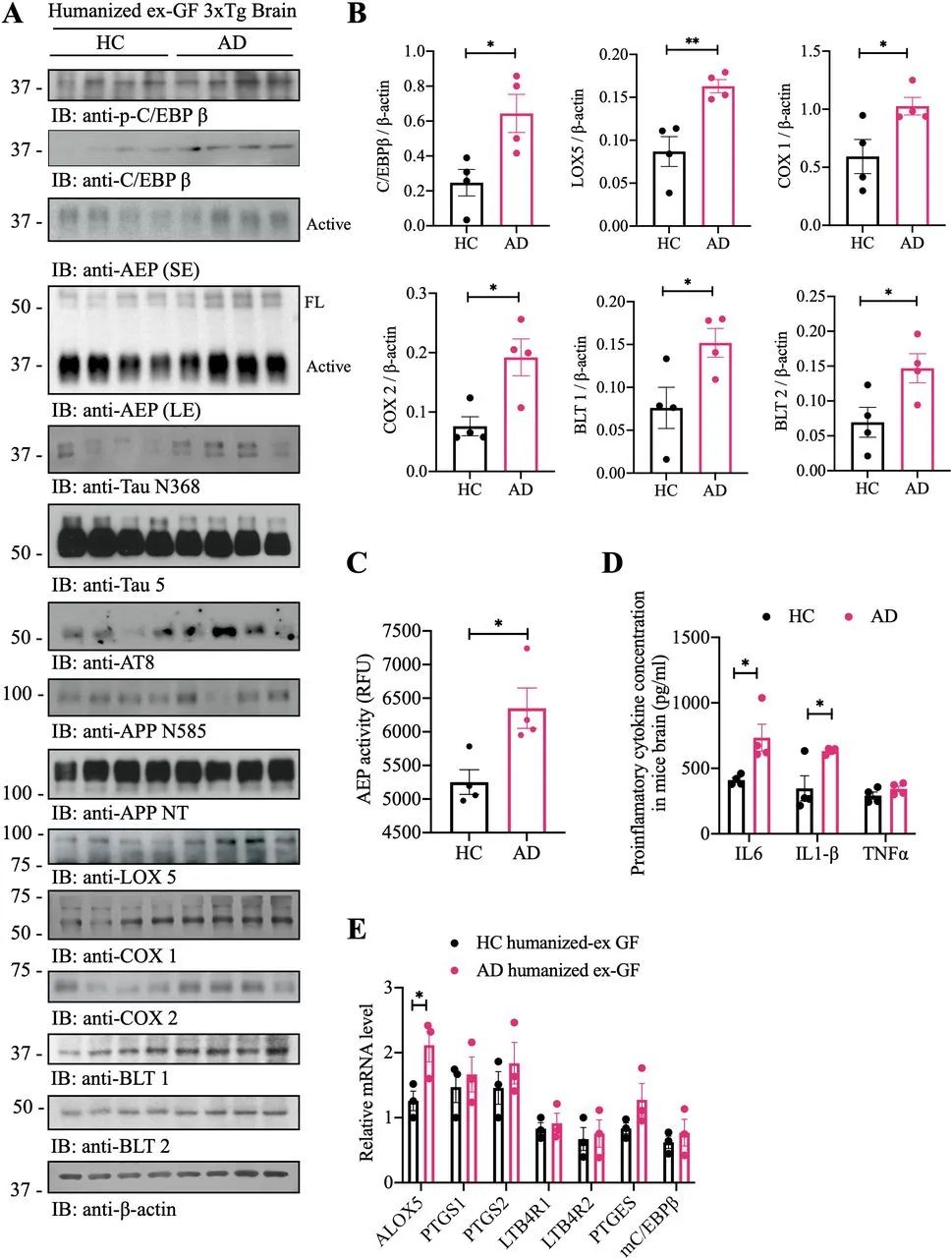
图7 AD粪便人源化ex-GF小鼠表现出C/EBPβ/AEP激活升高,与炎症升高有关。(A)免疫印迹显示HC人源化ex-GF 3×Tg小鼠和AD人源化ex-GF 3×Tg小鼠大脑中p-C/EBP β、C/EBP β、AEP、APP和tau蛋白表达和加工以及花生四烯酸代谢。(B)免疫印迹定量分析。用Image J统计C/EBPβ、LOX5、COX1、COX2、BLT1和BLT2的条带,并用β-肌动蛋白归一化。(C) HC人源化ex-GF 3×Tg小鼠和AD人源化ex-GF 3×Tg小鼠的脑裂解物中AEP活性测定。与HC人源化ex-GF 3×Tg小鼠相比,AD人源化ex-GF 3×Tg小鼠的AEP活性增加。(D) HC人源化ex-GF 3×Tg小鼠和AD人源化ex-GF 3×Tg小鼠的脑裂解物中促炎细胞因子IL1-β、IL-6和TNFα的浓度。(E) HC人源化ex-GF 3×Tg小鼠和AD人源化ex-GF 3×Tg小鼠大脑中涉及花生四烯酸代谢的基因相对mRNA水平。AD,阿尔茨海默病;AEP,天冬酰胺内肽酶;ANOVA,方差分析;COX,环氧酶;GF,无菌;HC,健康对照。
讨论
肠道微生物群在各种神经系统疾病的外周以及中枢免疫激活和炎症中起重要作用。在本研究中,我们提供的证据表明,肠道微生物组是AD小鼠模型中AD病理和认知缺陷所必需的。与SPF动物相比,在GF条件下3×Tg小鼠表现出小胶质细胞活化减少,老年斑块和NFT减少,以及空间记忆缺陷。RNAseq显示,与GF 3×TG小鼠大脑相比,SPF组中的胰岛素信号传导异常改变,促炎途径升高。此外,来自人源化GF小鼠大脑、血清和粪便的代谢组学分析确定了促炎信号升高和许多与SCFA减少相关的AA相关代谢物。用来自拟杆菌的AA代谢物PGE2-G治疗,在SCFA存在的情况下可恢复GF小鼠的AD病理和小胶质细胞活化。这一发现提供了一种由肠-脑轴驱动的潜在分子机制。与HC相比,移植AD微生物群的人源化小鼠空间记忆受损,表明Aβ和Tau过表达和生态失调相互作用并调节疾病进展。可以想象,这些临床前发现可能应用于人类,基因-微生物组相互作用可能为AD的发病机制提供见解。
C/EBPβ在神经炎症基因表达调控中起关键作用。因此,我们发现它在SPF或AD患者粪便移植小鼠大脑中的小胶质细胞中被激活,并提高了与AA代谢有关主要酶的mRNA转录(图2和7)。这些发现与先前的报告一致,即COXs、LOX5和PTGES的表达是由C/EBPβ介导的。Ptges3编码胞质前列腺素E合酶(cPGES),Pgtes2编码微粒体PGES-2(mPGES-2),cPGES和mPGES-2都是将PGH2转化为PGE2的重要PGES。cPGES优先与COX-1结合以将PGH2转化为PGE2,而mPGES-2可以与COX-1和COX-2结合产生PGE2以响应炎症。GF小鼠炎症和PGE2减少与Hpgd和Pgtes3 mRNA水平降低一致。而mPGES-2在组织中形成型表达,并且在组织炎症或损伤期间不会明显增加。据推测,由于GF小鼠中PGE2水平较低,因此Pgtes2可能会作为反馈补偿而增加(图3D)。Alox12基因编码酶及其反应产物调节血小板功能。在人类糖尿病患者的胰岛中观察到该基因的表达升高,但其在大脑中的作用尚不清楚。因此,它是否由C/EBPβ介导仍然未知。升高的酶导致各种AA代谢物上调,包括PGE2、血栓素B2、LKB4和12-HHT等,这些反馈刺激小胶质细胞激活,进一步加剧神经炎症。此外,C/EBPβ调节神经胶质激活中的许多促炎基因。与这些发现一致,PGE2-G和SCFA处理在GF 3×Tg小鼠中引起明显的小胶质细胞活化和AD病理(图4)。因此,在C/EBPβ和介导促炎AA代谢以放大神经炎症的酶之间存在恶性循环。除神经胶质细胞外,C/EBPβ还充当神经元中的关键转录因子,调节主要AD效应因子(包括APP、MAPT和AEP等)的表达。最近,我们报道了C/EBPβ/AEP信号在神经元中呈年龄依赖性增长,增多的APP和Tau蛋白随后被活性AEP截短,触发AD发病机制。有趣的是,C/EBPβ缺乏可在缺血性或兴奋性毒性损伤后提供神经保护,COX-2抑制对这两种模型是有益的。据推测,5×FAD肠道或AD粪便人源化的SPF小鼠和GF小鼠大脑中的C/EBPβ/AEP信号激活部分由AD受试者肠道生态失调引起的促炎AA代谢物介导(图2和7)。
对SPF和GF小鼠大脑的RNAseq分析揭示了AD病理中涉及的几个关键信号通路。例如,与GF小鼠相比,SFP小鼠的胰岛素/IGF-1途径及其下游效应子PI3激酶/Akt(PKB)和RAS/RAF/MAP激酶等发生明显改变(图3)。有趣的是,AD也被称为3型糖尿病(T3D)。AD患者的大脑中胰岛素及IR水平较低并出现整体胰岛素信号传导障碍。此外,T2DM个体发生轻度认知障碍(MCI)、痴呆或AD的风险增加。此外,AD患者表现出进行性脑胰岛素抵抗和胰岛素缺乏。T2DM或肥胖动物模型显示出认知障碍。使用胰岛素增敏剂或鼻内胰岛素治疗可改善动物模型和AD及MCI患者的认知能力。我们意识到,将AD与HC以及GF与SPF小鼠进行比较是不准确的。然而,3×Tg小鼠和野生型小鼠之间的胰岛素信号变化已经从以前的研究中得到了证实。越来越多的证据表明,包括雌性在内的3×Tg小鼠的葡萄糖耐量受损,葡萄糖耐量显著恶化,葡萄糖耐受不良和皮质淀粉样蛋白途径随着年龄的增长而恶化。胰岛素增敏剂的长期治疗改善了空间学习,并减弱了tau过度磷酸化和神经炎症。先前的研究表明,胰岛素信号传导和C/EBPβ相互调控。例如,胰岛素通过诱导C/EBPβ触发许多应激反应基因表达。值得注意的是,C/EBPβ通过结合其启动子介导IGF-1和人IR的表达。此外,C/EBPβ对于IGF-II介导的记忆巩固和增强必不可少,PGE2通过激活C/EBPβ上调IGF-1的表达。因此,这些观察结果支持肠道微生物群可能通过AA代谢物触发大脑中C/EBP/AEP通路激活,导致AD小鼠大脑中胰岛素/IGF-1信号异常。
代谢组学和HPLC分析表明,AA途径的促炎代谢物在与GF小鼠相比的SPF小鼠,及与HC粪便移植小鼠相比的AD菌群移植小鼠大脑和粪便样本中显著增加(图4I和5I)。这些观察结果与先前的报告一致,即与HC相比,AD患者粪便样本中的AA、PGE2和LKB4等升高,AD小鼠模型和AD患者大脑中AA代谢升高。值得注意的是,我们还发现,在用人类AD粪便样本重新定植的GF小鼠中,涉及AA代谢的拟杆菌菌株显著增多(图5C-E)。可以想象,肠道细菌将AA代谢为PGE2(图5I),这可能由于肠道生态失调引发的肠道渗漏而进入循环系统。在3×Tg小鼠中,由于BBB损伤,代谢物可能渗入大脑中,刺激小胶质细胞激活并引发神经炎症。以前的报告还显示,肠道微生物群会破坏BBB的完整性,导致BBB渗漏和内毒素浸润。
一些代谢组学研究已经检查了代谢与AD病理之间的关系。对血清、血浆和脑脊液(CSF)的研究已经确定了许多代谢途径,涉及胆汁酸、鞘脂、抗氧化剂、磷脂和氨基酸,这些途径似乎与疾病有关。对来自转基因动物模型和人类的脑组织样本的许多研究表明,神经递质、氨基酸和抗氧化剂的改变与AD和AD大脑中多胺代谢增加密切相关。有趣的是,AD人源化ex-GF小鼠大脑中的多巴胺显著降低,这与先前的报告相符,即AD患者的多巴胺较低。除次级胆汁酸、维生素和苯甲酸盐代谢物外,芳香族氨基酸代谢物的改变表明,与HC人源化ex-GF组相比,AD人源化ex-GF组的微生物代谢和/或微生物种群状态发生了改变,支持给药人类AD患者粪便改变了AD人源化ex-GF组的微生物群。戊糖在肠道内通过提供碳和能量的微生物作用代谢,戊糖代谢物的改变表明与HC人源化ex-GF组相比,AD人源化ex-GF组中微生物代谢和/或微生物种群的状态发生了改变。此外,糖酵解和TCA循环代谢物的差异提示葡萄糖利用、能量稳态和分泌的改变。脑磷脂水平升高,血清LCFA和肉碱结合脂质降低,以及粪便PE脂质增加,可能提示AD人源化ex-GF组的脂质代谢发生改变。鸟氨酸水平升高可能表明一氧化氮产生减少,与HC人源化ex-GF组相比,AD人源化ex-GF组血清(N-乙酰腐胺)和粪便(N-氨甲酰腐胺)中观察到的多胺代谢物水平较高。值得注意的是,有迹象表明肠道微生物代谢存在差异,从以下类别的代谢物中观察到的变化中可以明显看出:芳香族氨基酸代谢物、次级胆汁酸、维生素和苯甲酸盐。此外,碳水化合物和能量代谢物、脂质代谢物、精氨酸代谢物和氧化应激代谢物存在差异。有趣的是,膳食色氨酸的代谢物硫酸吲哚酚在AD人源化ex-GF小鼠与HC小鼠的血清和大脑中选择性升高,在SPF小鼠与HG小鼠的大脑中选择性升高。它破坏血脑屏障的完整性,增加氧化应激,并通过增加神经胶质细胞中的诱导性一氧化氮和COX-2、TNFα和IL-6而升高神经炎症。可以想象,它可以促进PGE2-G等炎症代谢物进入大脑以触发小胶质细胞激活。
无可争议的是,肠道细菌促进Aβ或Tau介导的病理机制可能很复杂;在目前的报告中,我们已经确定了一种潜在的通路,需要对小胶质细胞产生微生物群依赖效应。在GF或ABX(抗生素)处理的小鼠中,在没有微生物组的情况下,小胶质细胞的成熟和功能都会受损。例如,在GF和ABX处理的小鼠中,小胶质细胞表现出炎症基因表达谱显著改变,影响其监测功能,并伴有细胞形态的改变。长期ABX治疗导致雄性APP/PS1小鼠Aβ沉积和小胶质细胞形态改变减少,但雌性APP/PS1小鼠没有。本研究表明与SPF小鼠相比,GF小鼠中的小胶质细胞表现出不同的形态(图1F-I),表明GF小鼠的小胶质细胞成熟受损,这与先前的发现一致。与健康供体相比,用AD患者粪便样本对GF小鼠进行微生物再定植可激活小胶质细胞(图6H-K)。SCFAs,微生物群衍生的细菌发酵产物,调节小胶质细胞稳态。AD患者的肠道微生物群产丁酸盐关键菌种比例降低,例如Butyrivibrio和Eubacterium属成员。老年AD患者也表现出比没有痴呆的健康老人丁酸盐酶编码基因减少。因此,我们的观察结果与这些发现相符。与未处理小鼠相比,SCFAs处理加速了GF小鼠小胶质细胞的成熟,而添加PGE2-G代谢物进一步增加了小胶质细胞活化(图4J-L)。丁酸盐是一种必需的代谢物,是结肠上皮细胞的首选能量来源,它有助于维持肠道屏障,并具有免疫调节和抗炎特性。可以想象,AD肠道微生物群中缺乏产生抗炎丁酸盐的细菌,加上大脑中炎症性PGE2代谢物升高,增加了小胶质细胞活化,导致慢性神经炎症。随后激活C/EBPβ/AEP通路,提高APP和tau表达水平,增强AEP δ分泌酶活性,导致AD发病。
免责声明:本文仅代表作者个人观点,与中国益生菌网无关。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
版权声明
1.本站部分转载的文章非原创,其版权和文责属于原作者。2.本网所有转载文章、链接及图片系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,对可以提供充分证据的侵权信息,bio149将在确认后12小时内删除。3.欢迎用户投递原创文章至86371366@qq.com,经审核后发布到首页,其版权和文责属于投递者。







