内蒙古农大: 格氏乳杆菌G098可缓解DSS引起的小鼠炎症性肠病症状(国人佳作)
时间:2022-09-23 来源:微生态 作者:微科盟九卿臣 浏览次数:2679导读
炎症性肠病(IBD)是一种反复发作的胃肠道炎症性疾病,病因尚不明确,但通常被认为与免疫异常和肠道微生物失调等因素有关。而益生菌可以调节宿主免疫和肠道菌群;因此,我们研究了格氏乳杆菌G098(G098)对硫酸葡聚糖钠(DSS)诱导的小鼠结肠炎的缓解作用及机制。试验将小鼠分为三组(每组8只):正常对照组(NC),DSS诱导的结肠炎小鼠(DSS),以及给予菌株(G098)的结肠炎小鼠。结果显示,G098给药有效缓解了DSS诱导的结肠炎相关症状(减轻小鼠体重下降,降低疾病活动指数和病理评分;所有情况下的P<0.05),并防止了由于DSS诱导而引起的死亡的发生(DSS组存活率为62.5%;G098组存活率为100%)。同时,G098组的死亡率和炎症症状的改善伴随着更加健康的血清细胞因子平衡。相比DSS组,G098组的血清促炎因子IL-6、IL-1β、TNF-α显著下降,血清抗炎因子IL-13显著增加(P<0.05),肠道微生物组的多样性更高,Firmicutes和Lachnoclostridium明显增多,Bacteroidetes明显减少(P<0.05),以及糖降解相关途径的基因丰度明显更高(P<0.05)。综上所述,G098的摄入可以通过调节宿主免疫和肠道菌群来缓解DSS诱导的结肠炎,菌株治疗是一种有前景的IBD管理策略。
论文ID
原名:The Lactobacillus gasseri G098 strain mitigates symptoms of DSS-induced inflammatory bowel disease in mice
译名:格氏乳杆菌G098可缓解DSS引起的小鼠炎症性肠病症状
期刊:Nutrients
IF:6.706
发表时间:2022.9.10
通讯作者:陈永福
通讯作者单位:内蒙古农业大学乳品生物技术与工程教育部重点实验室
DOI号:10.3390/nu14183745
实验设计
经过1周的适应性训练,小鼠被随机分为三组(每组8只):NC组、DSS组和G098组。从第0天到第7天,NC组的小鼠自由饮用蒸馏水,而其他组在饮用水中添加DSS(2.5%,w/w)以诱导小鼠发生IBD。从第8天到第17天,NC组和DSS组接受0.9%生理盐水(0.2 mL/d)灌胃,而G098组接受G098乳杆菌(重悬于0.9%生理盐水中,4×109CFU/0.2 mL/d)灌胃。在整个实验过程中,每天观察并记录小鼠的体重、健康状态(腹泻、便血、活动)和死亡情况。在第18天,收集新鲜粪便并储存在-80℃条件下,用十二烷基硫酸钠法提取粪便DNA,用Qubit® 2.0荧光仪进行定量分析,并在Illumina NovaSeq PE150平台上进行DNA测序,由Agilent 2100 Bioanalyzer进行大小分布分析,并使用实时PCR进行定量,最后使用HUMAnN2进行分类学注释。同时通过挥发性异氟醚给药处死小鼠,清除结肠内容物,测量结肠长度和重量。之后,将结肠分为两部分:将远端结肠固定在4%多聚甲醛溶液中,经脱水、染色等操作后利用显微镜进行图像采集,然后通过CaseViewer软件对采集的图像进行组织学评估;其余部分在-80℃下冷冻。收集小鼠血液,通过离心(3000× rpm,4℃,10 min)获得血清,血清样品保存在-80℃,后续用ProcartaPlexTM对几种血清炎症细胞因子水平进行定量。
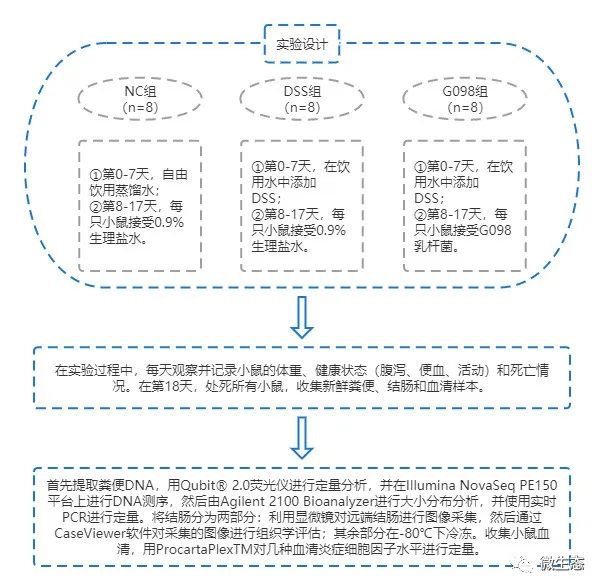
图1 实验设计图
前言
炎症性肠病(IBD)是一种发生在回肠、直肠和结肠的慢性、非特异性免疫介导的、复发性胃肠道疾病。在过去的250年中,IBD的发病率呈爆炸性增长。肠道菌群对人类健康具有关键作用,它为宿主提供营养和能量,帮助宿主抵御病原体,并调节肠道免疫系统。与健康个体相比,IBD患者的肠道菌群多样性和丰富度较低,宿主肠道菌群的失调状态也将破坏肠道免疫系统的平衡,激活异常的免疫反应。目前,主流的IBD治疗药物包括传统药物、生物制剂和小分子生物制剂等,这些药物主要作用在于缓解炎症。然而,患者对这些药物治疗的反应是有限的,且有许多非常昂贵,并且有严重的副作用,所以迫切需要找到治疗IBD的新策略。因此,微生物制剂和干细胞移植等新的治疗方法引起了人们的关注,寻找更安全、更有效治疗方法已成为IBD管理的研究热点之一。
结果
1 格氏乳杆菌G098减轻了结肠炎小鼠的炎症表现
在动物试验中,NC组和G098组的所有小鼠全部存活,但DSS组的三只小鼠分别在第8、10和14天死亡,最终存活率为62.5%(图2A)。在第1至7天,DSS组和G098组的DAI评分(根据体重减轻、腹泻和血便计算)显示出上升趋势,但NC组没有。在第7天,DSS组和G098组的DAI评分明显高于NC组(P<0.0001),而DSS和G098组之间没有明显差异(图2B),证实DSS处理导致DSS和G098组小鼠出现结肠炎。与DSS组相比,10天的菌株干预显著降低了G098组小鼠的DAI评分(P<0.05;图2C)和体重减轻(P<0.05;图2D)。此外,与DSS组相比,G098组小鼠的结肠长度/重量比增加(P>0.05;图2E)。
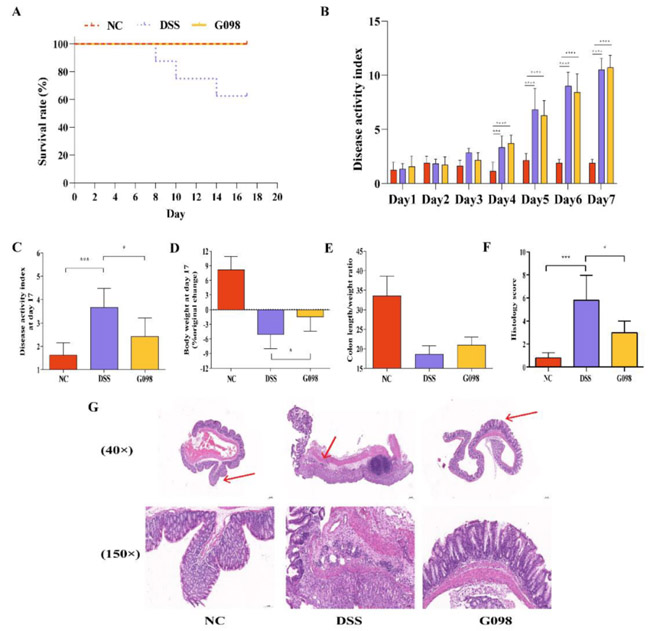
图2 正常对照组(NC)、硫酸葡聚糖钠(DSS)诱导组和格氏乳杆菌G098(G098)组之间炎症表现的差异。(A)各组存活率。(B)疾病活动指数的变化。(C)第17天相对于基线的疾病活动指数的变化。(D)第17天相对于基线的体重变化。(E)结肠长度/重量比。(F)组织学评分。(G)结肠组织的苏木精和伊红染色显微图像(40×和150×放大),显微图像(150×放大)是红色箭头所示区域的放大图像。误差线代表平均值的标准偏差。统计分析采用Tukey多重比较检验(*P<0.05;**P<0.01;***P<0.001)。
2 摄入格氏乳杆菌G098可逆转DSS引起的血清促/抗炎细胞因子水平的变化
在第18天测量了血清中促炎细胞因子IL-1β、IL-6和TNF-α(图3A-3C)以及抗炎因子IL-10和IL-13(图3D、3E)的水平。DSS组的三种促炎细胞因子水平都明显高于NC组,但在G098组明显较低(IL-1β:NC组0.71±0.63 pg/mL,DSS组10.85±7.26 pg/mL,G098组1.06±0.76 pg/mL,DSS vs NC,P<0.01,DSS vs G098,P<0.01;IL-6:NC组0.45±0.49 pg/mL,DSS组56.09±48.36 pg/mL,8.57±9.26 pg/mL,DSS vs NC,P<0.01,DSS vs G098,P<0.05;TNF-α:NC组2.56±0.51 pg/mL,DSS组6.50±2.28 pg/mL,G098组3.22±1.09pg/mL,DSS vs NC,P<0.001,DSS vs G098,P<0.001;图3A-3C)。NC组的IL-13和IL-10水平分别为1.84±1.43 pg/mL和9.75±8.02 pg/mL,DSS组IL-13水平明显(0.30±0.25 pg/mL,P<0.05;图3E)降低,而IL-10水平(3.81±2.99 pg/mL,P>0.05;图3D)降低不显著。菌株干预使IL-13水平显著增加(G098为1.61±0.88 pg/mL,P<0.01;图3E),而IL-10水平(G098为7.32±3.09 pg/mL,P>0.05;图3D)增加不显著。
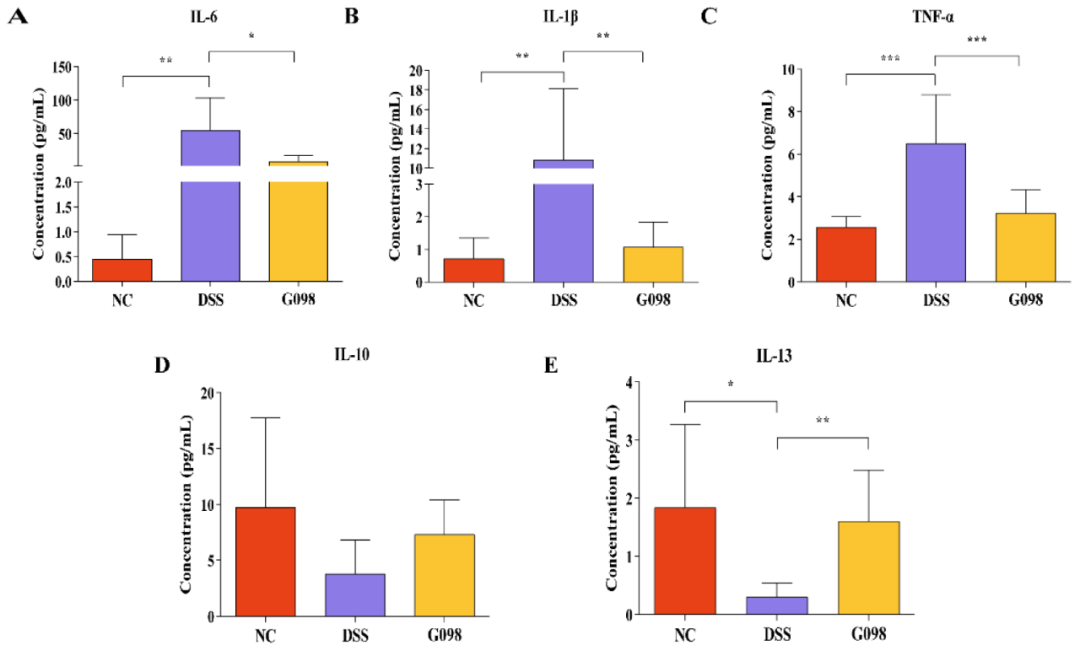
图3 正常对照组(NC)、硫酸葡聚糖钠(DSS)诱导组和格氏乳杆菌G098(G098)组的血清细胞因子水平的差异。(A)白细胞介素(IL)-6;(B)IL-1β;(C)肿瘤坏死因子(TNF)-α;(D)IL-10;和(E)IL-13的水平。误差线代表平均值的标准偏差。用Tukey多重比较检验评估组间差异(*P<0.05;**P<0.01;***P<0.001)。
3 格氏乳杆菌G098对肠道菌群组成的影响
Simpson指数和Shannon指数是衡量微生物多样性的指标。与NC组相比,DSS组小鼠的Simpson和Shannon指数值明显降低(分别为P<0.05和P<0.05),G098给药缓解了DSS引起的肠道微生物多样性的减少(两种情况下均为P<0.05;图4A、4B)。然后,通过主坐标分析(PCoA;Bray-Curtis距离;图4C)对小鼠肠道菌群的β-多样性进行分析。在PCoA图中,代表NC组的符号聚集在一起,而代表DSS和G098组的大多数符号在图中的位置很接近。t检验证实,正常小鼠和DSS处理的小鼠肠道菌群结构在有/无菌株处理时存在明显差异(NC vs DSS,R2=0.3955,P=0.005;NC vs G098,R2=0.2033,P=0.002)。然而,G098处理可以在一定程度上减少这种差异(R2=0.1534,P=0.117),尽管G098组和DSS组之间有部分重叠(图4C)。
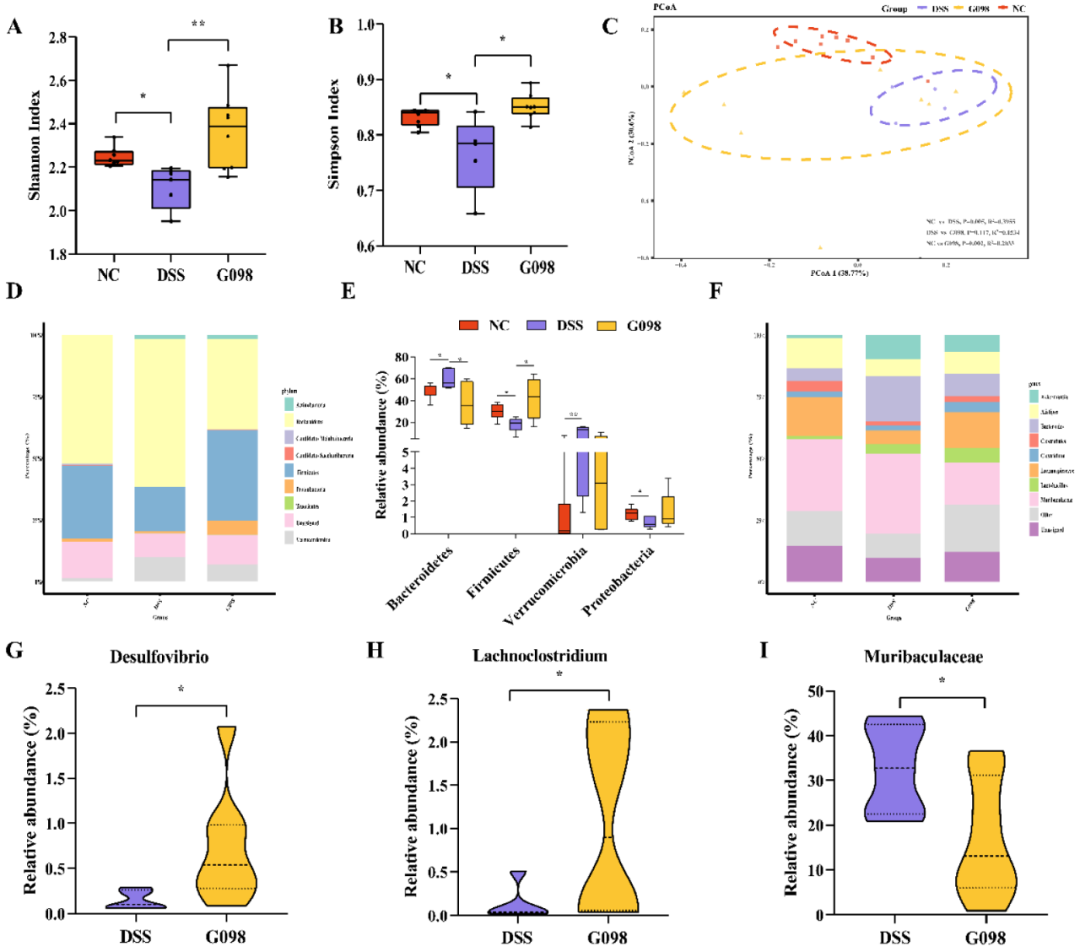
图4 正常对照组(NC)、硫酸葡聚糖钠(DSS)诱导组和格氏乳杆菌G098(G098)组的肠道菌群分类。(A) Shannon指数。(B) Simpson指数。(C) 小鼠肠道菌群的主坐标分析(PCoA;Bray-curtis距离)得分图。(D) 门水平肠道菌群分布。(E)Bacteroidetes、Firmicutes、Proteobacteria和Verrucomicrobia的相对丰度。(F) 属水平肠道菌群分布。(G-I)小提琴图显示了Desulfovibrio、Lachnoclostridium和Muribaculaceae的相对丰度。误差线代表平均值的标准偏差。采用Tukey多重比较检验进行统计分析(*P<0.05;**P<0.01)。
4 格氏乳杆菌G098对肠道菌群代谢途径的影响
火山图显示了在肠道菌群中检测到的代谢途径的P值(t检验)和倍数变化(FC)(共228条代谢途径;图5A)。与DSS组相比,G098组检测到5条明显增加的代谢途径,包括D-半乳糖降解V(Leloir途径)、半乳糖降解I(Leloir途径)、水苏糖降解、CMP-3-deoxy-D-manno-octulosonate生物合成I和L-谷氨酸降解V(通过羟基戊二酸)(P<0.05和FC≥2或≤0.5;图5A)。
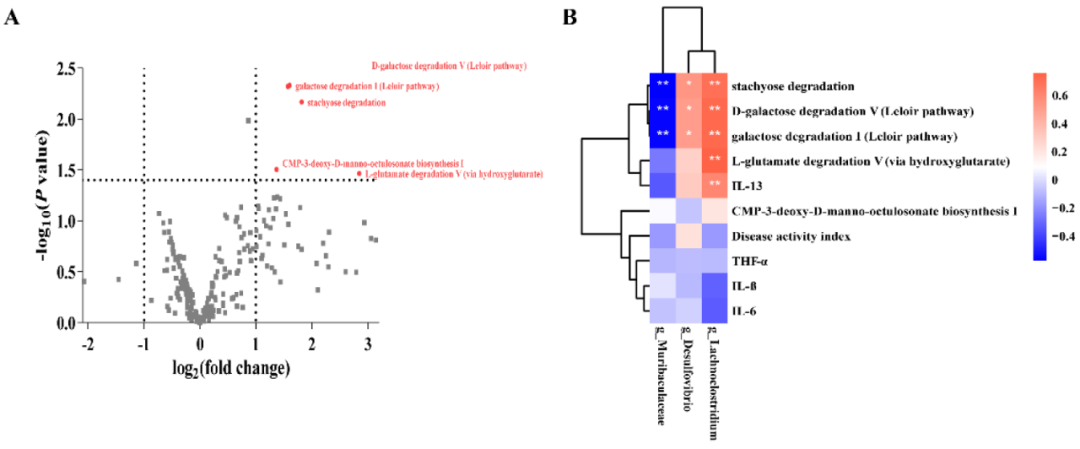
图5 差异类群、代谢途径和相关性分析。(A)火山图显示葡聚糖硫酸钠(DSS)诱导组和格氏乳杆菌G098(G098)组的肠道菌群之间的差异代谢途径(临界值:P<0.05和FC≥2或≤0.5),每个点代表一个检测到的途径,差异代谢途径以红色显示并有注释。(B)Spearman相关热图显示了差异类群、代谢途径、血清细胞因子水平和疾病活动指数之间的关联。*和**分别代表P<0.05和P<0.01,色标代表r值。
5 显著差异肠道菌群与肠道代谢途径、血清细胞因子和DAI之间的相关性
然后,对肠道菌群、细胞因子和DAI编码的差异代谢通路与显著变化的属水平细菌进行相关性分析。确定了几个重要的关联(图5B)。Muribaculaceae与D-半乳糖降解V(Leloir途径;P<0.01,R=-0.56)、半乳糖降解I(Leloir途径;P<0.01,R=-0.56)和水苏糖降解(P<0.01,R=-0.58)呈显著负相关。相反,Desulfovibrio和Lachnoclostridium与D-半乳糖降解V(Leloir途径;分别为P<0.05,R=0.51;P<0.01,R=0.72)、半乳糖降解I(Leloir途径;分别为P<0.05,R=0.51;P<0.01,R=0.72)和水苏糖降解(分别为P<0.05,R=0.54;P<0.01,R=0.70)呈显著正相关。此外,Lachnoclostridium还与L-谷氨酸降解V途径(通过羟基谷氨酸)(P<0.01,R=0.76)和细胞因子IL-13(P<0.01,R=0.60)呈正相关。
讨论
本研究分析了在DSS诱导的结肠炎小鼠模型中施用格氏乳杆菌G098对IBD临床表现的有益影响。研究结果显示格氏乳杆菌G098能有效缓解结肠炎相关症状,并伴随着小鼠肠道菌群和代谢途径的一些变化。
本研究通过连续7天在饮水中给予2.5%的DSS(W/V),成功诱导小鼠结肠炎,模拟了IBD症状。DSS组的小鼠体重下降,且肉眼可见小鼠粪便松散带血。在第7天,DSS组的DAI评分明显高于NC组(图2B)。用G098干预10天后,DAI评分明显下降,扭转了体重下降的趋势,并减轻了DSS引起的结肠炎症状(图2C-E)。通过HE染色对小鼠结肠病理进行了观察和评分,发现G098可以明显缓解DSS诱导的结肠组织中的肠腺损伤,同时大大降低了炎症细胞的浸润程度,病理评分与DSS组相比也明显降低(图2F-G)。这些结果均表明G098能有效缓解IBD相关的症状。重要的是,在整个实验过程中,G098组小鼠没有死亡(而DSS组的存活率为62.5%;图2A),进一步证实了G098的摄入对DSS诱导的疾病的保护作用。
有研究认为,不同细胞因子的水平和功能与IBD的严重程度密切相关,通过调控细胞因子的分泌可以缓解肠道炎症。IL-1β和IL-6是两种关键的促炎细胞因子,参与了多种自身免疫性炎症反应和细胞活动。另一方面,TNF-α在IBD的发病机制中同样起着重要作用,它能诱导结肠上皮细胞大量凋亡,参与固有层的炎症反应和上皮细胞脱落,增加肠道屏障细胞的通透性,从而加重炎症反应。此次研究发现,在DSS处理的小鼠中,G098的给药具有普遍的抗炎作用,表现为促炎症和抗炎症细胞因子水平的降低和增加(图3),这可能是保护小鼠免受结肠炎的重要机制。
众多研究表明,结肠炎的发生和缓解与肠道菌群密切相关,IBD患者的肠道菌群多样性降低,微生物群结构和组成发生改变,Escherichia coli等有害细菌水平升高,Firmicutes和Alistipes等有益细菌丰度降低。微生物宏基因组分析发现DSS与NC小鼠之间以及DSS与G098小鼠之间存在不同的细菌家族(图4D-F)。然而,在DSS干预后,Akkermansia muciniphila相对丰度的变化趋势与以往的研究不同。这种差异可能与动物模型、是否与其他致病菌共存以及宿主性别等因素有关,值得进一步研究。
本研究发现,G098的摄入可以显著提高DSS组肠道菌群的α-多样性(图4A、4B),缩小DSS组和NC组小鼠之间肠道菌群结构组成的差异(图4C)。G098处理也明显提高了肠道Firmicutes的相对丰度,同时降低了肠道Bacteroidetes的比例(图4D-E)。G098给药后Firmicutes/Bacteroidetes比例的增加表明该菌株可以有效逆转DSS引起的微生物群失调。在属水平上,G098组Lachnoclostridium的相对丰度明显高于DSS组(图4H)。SCFAs与肠道炎症密切相关,它们参与了抗炎信号的多种代谢途径。此外,本研究发现Lachnoclostridium与抗炎因子IL-13之间存在显著正相关关系(图5B),表明G098给药对调节宿主肠道免疫反应具有潜在作用。另一方面,以往的研究发现,DSS组的Desulfovibrio比益生菌干预组更丰富,与当前G098组Desulfovibrio比例较低的结果相反(图4G)。Desulfovibrio能在肠道内产生硫化氢(H2S),对肠道上皮细胞有毒性,引起胃肠道疾病。然而,已经发现H2S可以直接促进血管生成,因此有利于胃肠道溃疡的愈合,这可能是由于溃疡边缘的粘膜血流增强,促进溃疡修复。
最后,采用HUMAnN2来识别肠道微生物组编码的潜在功能途径,结果显示共有228条通路。与DSS组相比,G098组编码的基因丰度较高,包括糖降解相关途径(如水苏糖降解、D-半乳糖降解V(Leloir途径)和半乳糖降解I(Leloir途径),以及L-谷氨酸降解V(通过羟基戊二酸);图5A)。谷氨酸是产生乙酸盐和丁酸盐等SCFAs的主要原料,肠道SCFAs在肠道上皮细胞的能量供应、电解质平衡、维护肠道粘膜屏障、调节免疫和抗肿瘤作用方面发挥着重要的生理作用。L-谷氨酸降解V(通过羟基戊二酸)的代谢途径与Lachnoclostridium呈显著正相关,Lachnoclostridium是一个已知产生SCFAs的细菌属。因此,G098可能刺激编码上述途径的部分肠道菌群生长,并调节部分生理功能,包括SCFA的产生和加强肠道粘膜屏障,缓解肠道炎症。
综上所述,格氏乳杆菌G098治疗可以缓解DSS诱导的小鼠炎症性肠病的症状。未来,需要进一步探索格氏乳杆菌G098缓解结肠炎的具体机制,并继续开展相关的纵向研究,为应用格氏乳杆菌G098治疗和防治IBDs提供更多证据。
结论
本研究表明,格氏乳杆菌G098可以通过减少结肠组织的粘膜损伤、调节免疫反应、恢复肠道菌群多样性和增加肠道菌群稳定性等途径来缓解DSS引起的小鼠结肠炎。未来应进一步评估格氏乳杆菌G098对IBD的临床疗效,以及格氏乳杆菌G098缓解实验性结肠炎的具体机制。
原文链接:https://www.mdpi.com/2072-6643/14/18/3745
免责声明:本文仅代表作者个人观点,与中国益生菌网无关。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
版权声明
1.本站部分转载的文章非原创,其版权和文责属于原作者。2.本网所有转载文章、链接及图片系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,对可以提供充分证据的侵权信息,bio149将在确认后12小时内删除。3.欢迎用户投递原创文章至86371366@qq.com,经审核后发布到首页,其版权和文责属于投递者。







