内蒙古农大: 益生菌Probio-M8与常规疗法协同治疗帕金森病
时间:2022-12-22 来源: 作者:九卿臣 浏览次数:2246导读
帕金森(PD)主要通过药物(如苄丝肼和多巴胺激动剂)进行治疗,然而长期使用这些药物会逐渐降低它们的多巴胺作用,在一些PD患者中观察到肠道菌群失调,这表明肠道菌群与PD密切相关,并且益生菌能够有益调节宿主的肠道菌群。通过一项为期3个月的随机、双盲、安慰剂对照临床试验,以探究益生菌联合给药对PD患者的有益作用。本研究共招募了133名PD患者,最终只有82名患者完成了试验(附图1),将其随机分为益生菌组(n=48;Bifidobacterium animalis subsp. lactis Probio-M8(Probio-M8)、苄丝肼、多巴胺激动剂)和安慰剂组(n=34;安慰剂、苄丝肼、多巴胺激动剂)。最后Probio-M8组和安慰剂组的45名和29名患者分别提供了连续的粪便和血清样本,用于进一步的组学分析。结果显示,Probio-M8联合给药可改善睡眠质量、缓解焦虑和胃肠道症状,宏基因组分析显示干预后Bifidobacterium animalis,Ruminococcaceae和Lachnospira物种水平的基因组(SGB)显著增加,而Probio-M8组Lactobacillus fermentum和Klebsiella oxytoca显著减少(P<0.05)。Lactobacillus fermentum与UPDRS-III、HAMA、HAMD-17评分呈正相关,与MMSE评分呈负相关,而Klebsiella oxytoca与粪便硬度呈负相关。此外,联合服用Probio-M8增加了参与色氨酸降解、γ-氨基丁酸、短链脂肪酸和次级胆汁酸生物合成以及血清乙酸和多巴胺水平(P<0.05)。综上所述,Probio-M8与常规方案协同治疗,增强了帕金森病临床治疗的疗效,同时改变了宿主肠道菌群、肠道菌群代谢潜能和血清代谢物。
论文ID
原名:Probiotics synergized with conventional regimen in managing Parkinson’s disease
译名:益生菌与常规疗法协同治疗帕金森病疾病
期刊:npj Parkinson's Disease
IF:9.304
发表时间:2022.5
通讯作者:张和平, 张金彪
通讯作者单位:内蒙古农业大学乳品生物技术与工程教育部重点实验室
DOI号:10.1038/s41531-022-00327-6
实验设计
本研究为一项为期3个月的随机、双盲、安慰剂对照临床试验。共招募了133名PD患者,最终只有82名患者完成了试验(附图1),随机分为益生菌组(n=48)和安慰剂组(n=34)。益生菌组患者每天服用2克的Probio-M8粉剂(3×1010 CFU/d;麦芽糖糊精作为辅料)和苄丝肼、多巴胺激动剂,而安慰剂组患者每天服用2克安慰剂粉剂(仅服用麦芽糖糊精)和苄丝肼、多巴胺激动剂,持续180天。分别在干预前(0d)、干预开始后一个月(1M)和三个月(3M)采集患者粪便和血液样品,并填写记录临床症状和GI及便秘相关问题的调查问卷,包括统一PD评分量表III(UPDRS-III)、细微精神状态检查表(MMSE)、汉密尔顿焦虑量表(HAMA)、汉密尔顿抑郁量表-17 (HADM-17)、帕金森睡眠量表(PDSS)、视觉模拟量表(VAS)、日常生活活动表(ADL)、便秘生活质量表(PAC-QCL)。使用QIAamp Fast DNA Stool Mini Kit从患者的粪便中提取宏基因组DNA,在Illumina NovaSeq平台上进行测序。
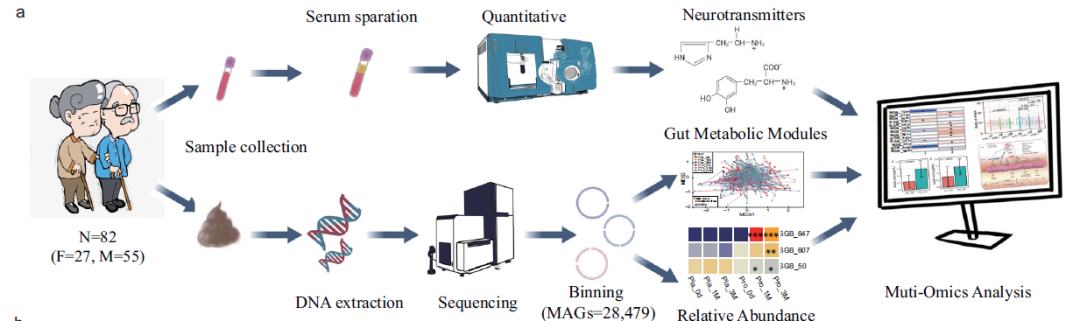
图1 实验设计示意图(原文中图1a)
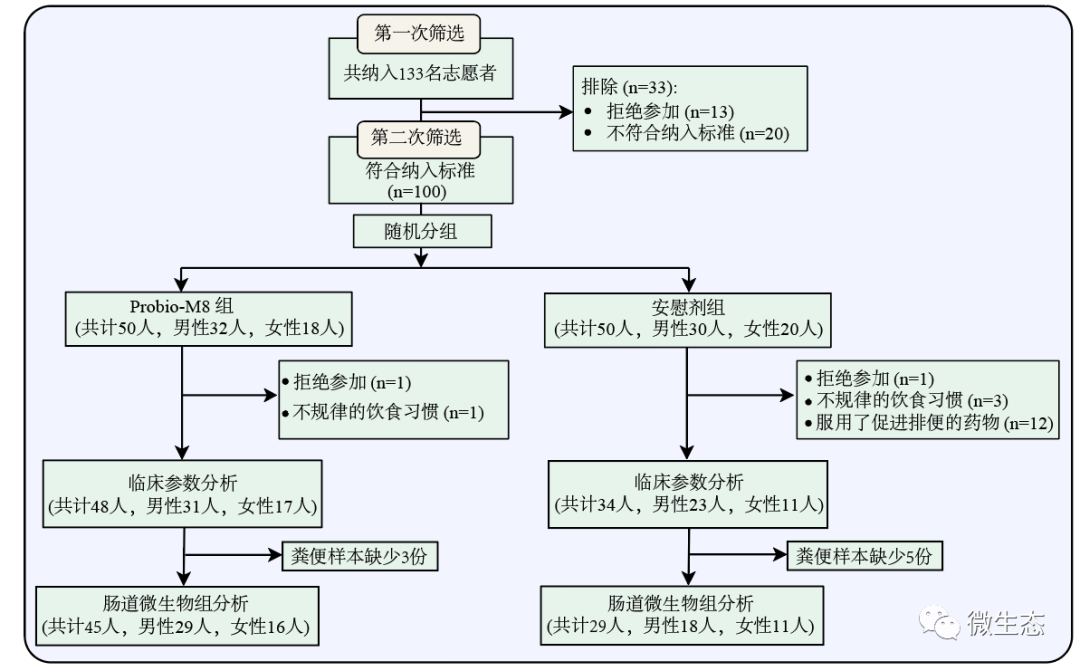
图2 实验受试者纳排流程(原文中附图1)
前言
帕金森(PD)是一种神经退行性疾病,全世界有700万到1000万人患病,它被认为是一种由遗传和环境原因引起的多因素疾病,PD患者有典型的运动症状,如静息性震颤、运动迟缓和僵硬以及胃肠道(GI)症状,包括便秘、结肠转运时间较慢和小肠细菌过度生长,而PD患者的胃肠道症状往往先于运动体征,表明肠道异常与PD的发病之间存在关联。肠道被认为是人类的第二个大脑,它包含了一个动态的肠道菌群,其微生物基因组是人类基因组的100多倍。PD患者中经常观察到肠道菌群和代谢组的改变,例如在PD患者中条件致病菌(Anaerococcus,Campylobacter和Lactobacillus)的比例升高,而Blautia,Butyricicoccus,Lachnospira和其他一些短链脂肪酸(SCFA)产生菌减少。此外,一些肠道微生物(如Lachnospiraceae和Enterobacteriaceae)的丰度与PD及其相关症状的严重程度显著相关。“肠-脑轴”是一个相对较新的概念,提出了肠道和大脑之间存在双向通信通路,两个身体部位之间通信和相互作用的失调可能与包括PD在内的神经退行性疾病有关。Sampson等人发现,PD病理中最重要的物质α-突触核蛋白,可通过迷走神经从肠道传递到大脑,从而导致运动障碍,证实了肠道在驱动PD的发展和发病机制中的积极作用。越来越多的证据表明肠道菌群具有合成或调节各种神经化学物质和神经代谢物的能力,这些物质可能直接或间接影响机体的生理过程以及PD的发生和发展。Marcus等人发现将年轻小鼠的菌群移植到老年小鼠中,通过调节SCFAs和神经递质的产生,逆转了认知和行为缺陷的相关损伤。左旋多巴(多巴胺的前体)、γ-氨基丁酸(GABA)和5-羟色胺(5-HT)可由肠道中的某些微生物产生,并通过体循环传播到大脑,最终缓解神经退行性疾病。
目前PD的主要治疗方法是服用抗帕金森药物,如左旋多巴、苄丝肼、西瑞林和普拉克索,药物治疗可改善PD相关症状,但多巴胺的治疗效果会逐渐减弱,最终需要更大剂量的药物治疗。因此许多替代疗法和辅助疗法(如运动训练和针灸)已经被开发出来并应用于PD的治疗。由于肠-脑轴的存在以及肠道生态失调与PD病理之间的密切联系,靶向调节肠道菌群可能是一种缓解PD的有趣的替代或辅助治疗方法。
益生菌被定义为“在给予足够量时对宿主有益的活的微生物”,每天服用复合益生菌[Bifidobacterium (B.) bifidum,B. longum和Lactobacillus (L.) rhamnosus GG]16周,可对多巴胺神经元产生保护作用,并显著改善PD小鼠运动障碍(例如步态模式和身体平衡)。一种工程胰高血糖素样肽-1的益生菌菌株可以减轻PD模型小鼠的神经炎症,证明减轻了脂多糖诱导的记忆障碍和1-甲基-4-苯基-1,2,3,6-四氢吡啶(MPTP)相关运动障碍。除了小鼠模型外,一些双盲随机安慰剂对照试验(RCTs)表明,益生菌对PD患者产生了有益作用,可以缓解胃肠道症状(包括腹痛、腹胀、恶心、便秘和自发性排便)。另一方面益生菌对PD相关运动和非运动症状以及炎症因子的影响的研究结果并不一致,一项研究表明使用复合益生菌(包括 L. acidophilus,B. bifidum和L. fermentum)改善了PD评定量表(MDS-UPDRS)评分、血液谷胱甘肽、高敏C反应蛋白、丙二醛和胰岛素,然而其他研究发现MDS-UPDRS和非运动症状量表(NMSS)、炎症和氧化应激生物标志物(复合益生菌含有L. acidophilus,L. casei,B. bifidum和L. fermentum)以及粪便钙保护素(含Enterococcus(E.)faecium,L. acidophilus,L. paracasei,L. rhamnosus,B. longum,B. bifidum,L. reuteri和E. faecalis的复合益生菌)不受益生菌的影响。这些报告为PD患者摄入益生菌的积极影响提供了证据,然而益生菌菌株特异性和宿主条件等因素可能会影响最终的临床结果,因此有必要进行个别试验以确认每种情况下特定益生菌对健康的促进作用。此外由于治疗PD的常规药物可能会引起显著的副作用,因此探索辅助益生菌治疗的临床效果,寻找一种与传统治疗方法协同治疗PD的新候选菌株是有意义的,而很少有研究涉及这一问题。
Bifidobacterium animalis subsp. lactis Probio-M8(Probio-M8)是从一名健康妇女母乳中分离出来的一种新的益生菌菌株。服用Probio-M8可以减轻阿尔茨海默症动物模型APP/PS1转基因小鼠的认知障碍,也被用作复合益生菌配方的菌株之一,可缓解长期水手的焦虑和压力状态。基于这些报道,假设Probio-M8是缓解神经退行性疾病和其他神经系统疾病的潜在候选精神益生菌。本研究旨在通过一项双盲随机对照试验评估Probio-M8联合常规方案(苄丝肼和多巴胺激动剂)辅助治疗的有益效果和机制,通过在干预期间和干预过程后参与者的一些临床指标、肠道菌群和血清代谢组的变化来评估临床结果。
结果
1. Probio-M8联合用药减轻了PD相关症状
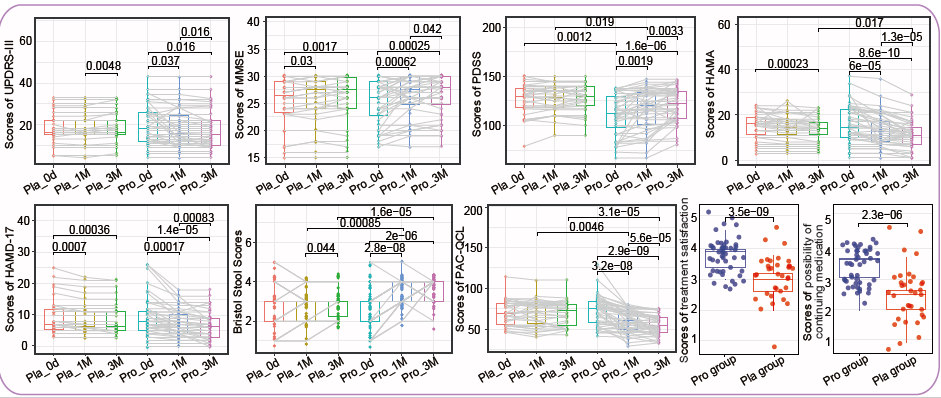
图3 帕金森病的临床指标。分别采用配对t检验和t检验对组内、组间的临床参数的统计学差异。样本间的显著性P值于图中标注。箱线图要素:中线、中位数;箱限,上、下四分位;晶须,1.5倍四分位范围;点,离群值。每个点代表一个参与者的一个数据点,同一参与者在不同时间点的数据用直线连接。“Pro”和“Pla”分别代表Probio-M8组和安慰剂组。“0d”、“1M”、“3M”分别代表基线(干预前)、干预后一个月以及干预后三个月。UPDRS-III,MMSE,PDSS,HAMA,HAMD-17,PAC-QOL分别代表统一帕金森评定表III、细微精神状态检查、帕金森病睡眠量表、汉密尔顿焦虑量表、汉密顿抑郁量表17以及便秘患者生活质量的评估。(原文中图1b)
2. Probio-M8修饰了PD患者的关键肠道细菌
Shannon多样性指数已被用于评价粪便菌群的丰富度和多样性,在纵向(同一组的不同时间点)和水平(不同组间的同一时间点)比较中,Shannon多样性指数均无显著变化(图3a),同时PCoA(Bray-Curtis距离)评分图没有显示出任何基于时间的聚类模式(P>0.05,图3b)。这些结果表明添加或不添加益生菌的药物治疗都不会引起受试者肠道菌群多样性和结构的剧烈变化。此外以年龄为基础的肠道菌群结构比较无显著差异(成人:45-59岁;年轻老年人:60-74岁;老年人:75-87岁;ANOSIM检验,P=0.414,R=0.006;附图2)。通过更精细的分类分析,在成分水平上揭示了益生菌驱动的粪便菌群的调节。B. animalis(SGB_647)的丰度在第0天的所有样本中均处于非常低的水平(0.15;仅在安慰剂组的2名患者和Probio-M8组的1名患者中检测到)。在整个干预期间,安慰剂组B. animalis的丰度一直较低(1个月时为0.059,3个月时为0.044,仅在上述两名患者中检测到),但随着时间的推移Probio-M8组的B. animalis丰度显著增加(与基线水平相比1个月时为4.57,P=0.003;3个月时为2.52,P=0.048)。在同一时间点,干预组之间的水平比较也显示,Probio-M8组B. animalis的丰度持续显著增加(分别在1个月和3个月时,P=2.8e-08和P=1.1e-05)。尽管本研究中采用的标准测序深度(每个样本5.08±1.11 Gbp)与大多数类似性质的宏基因组测序研究一样,不足以在粪便宏基因组数据集中追踪目标微生物的菌株水平,但所有参与者都被要求避免摄入B. animalis的主要食物来源,如酸奶、发酵乳饮料、益生菌制剂等。因此B. animalis 的SGB显著增加可能反映了患者肠道中提供的菌株(Probio-M8)的数量,同时这些结果证实了试验期间参与者的依从性。
试验共鉴定出48个反应性SGB,在基线时Probio-M8组和安慰剂组之间没有显著差异,但在干预过程中和干预后出现差异(图3c,3d;附表6)。对同一组在不同时间点的SGB进行纵向比较,发现对照组在3个月时只有一个SGB_567(Butyricimonas sp. CAG:1)显著下降,另外9个SGB在Probio-M8组较晚的时间点丰度发生显著变化(图3c),如益生菌组在1个月和3个月时Parabacteroides (P.) distasonis (SGB_536),Mycoplasma sp. CAG:1 (SGB_83)和Evtepia gabavorous (SGB_220)的丰度下降(图3c)。Probio-M8组与安慰剂组在同一时间点进行水平比较,发现28个显著差异的SGB(图3d),Klebsiella (K.) oxytoca (SGB_27) 和L. fermentum (SGB_127)的SGB水平降低,相比之下Probio-M8组的Ruminococcaceae [Ruminococcaceae sp. CAG:18 (SGB_317),Ruminococcaceae sp. CAG:20 (SGB_316),uncultured Ruminococcus sp. (SGB_342)], Lachnospira [Lachnospira eligens (SGB_377),uncultured Lachnospira sp. (SGB_378)]和Butyricimonas [Butyricimonas sp. CAG:1(SGB_567)] SGB水平增加。研究结果表明,联合补充Probio-M8可以通过抑制一些潜在的致病类群而增加有益的类群来调节患者的肠道菌群。
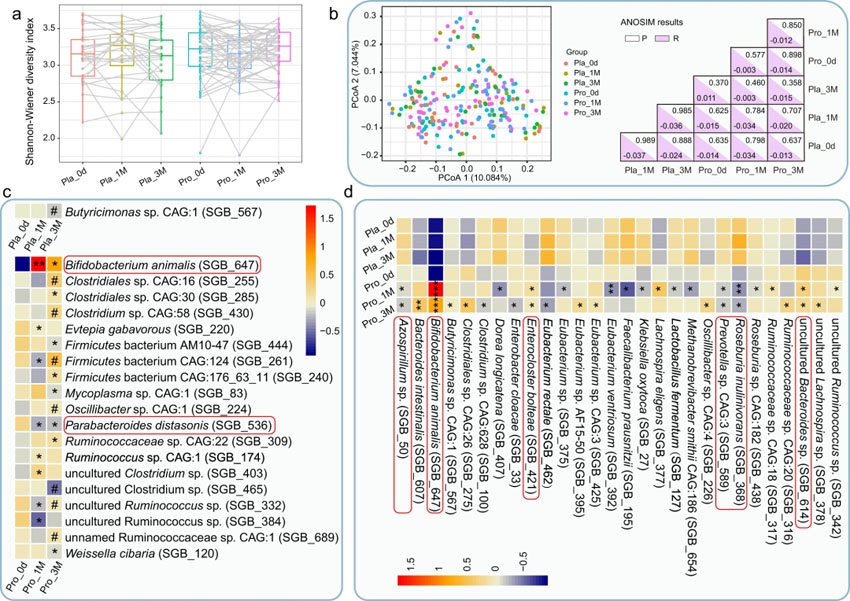
图4 组间微生物多样性和差异性物种水平基因组箱(SGBs)。(a)安慰剂组和Probio-M8组分别在0d、1M、3M的粪便微生物香农多样性指数。组内Shannon多样性指数的统计学差异采用配对t检验。每个点代表一个参与者的一个数据点,同一参与者在不同时间点的数据用直线连接。箱线图要素:中线、中位数;箱限,上、下四分位;晶须,1.5倍四分位范围;点,离群值。(b)左图为两组在不同时间点的主坐标分析(PCoA)图。每个子组的样本用不同的颜色表示。右图为相似度分析的P值和R值(ANOSIM,999 permutations)。(c)纵向比较同一组不同时间点的SGBs丰度。所有SGBs在基线时组间无显著差异,但在实验期间显著增加/减少。0d时的SGBs与其他时间点的显著性差异以*P<0.05、**P<0.01表示;1M~3M之间用P<0.05表示。(d)Probio-M8组与安慰剂组在同一时间点的SGBs丰度水平比较。所有SGBs在基线时组间均无显著性差异,但在干预期间或干预后存在显著性差异。显著性差异:*P<0.05,**P<0.01,***P<0.001。(c)和(d)中的红色角矩形表示任意尺度下SGBs的丰度。Pro和Pla分别代表Probio-M8组和安慰剂组。“0d”、“1M”、“3M”分别为干预前、干预后1个月、干预后3个月。(原文中图2)
3. PD患者的临床数据与肠道菌群之间的多变量相关性
采用MaAsLin2对肠道菌群与UPDRS、心理数据(MMSE、PDSS、HAMA和HMAD)以及排便相关临床指标之间的多变量相关性进行分析。结果显示MMSE、PDSS、HAMA、HAMD、UPDRS评分(图4a、4b)、粪便硬度和自发排便次数(图4c)与90个肠道SGB(相对丰度>0.2%;P<0.005)的七项临床指标之间存在强相关性。
其中9种是对益生菌补充剂有特异性反应的生物标志物物种,包括Bacteroides (B.) intestinalis (SGB_607),Clostridiales sp. CAG:16(SGB_255),Clostridium sp. CAG:628(SGB_100),Firmicutes bacterium AM10−47(SGB_444),Firmicutes bacterium CAG:124(SGB_261),K. oxytoca (SGB_027),L. fermentum (SGB_127),Roseburia inulinivorans(SGB_368)和uncultured Ruminococcus sp. (SGB_384)。特别值得注意的是Probio-M8组的L. fermentum(SGB_127)减少,并发现它与多个临床参数相关,与UPDRS、HAMA、HAMD-17评分显著正相关,与MMSE评分显著负相关(图4a,4b)。Klebsiella oxytoca(SGB_27)与两种不同的临床指标,即HAMA评分和粪便硬度呈负相关(图4a,4c)。
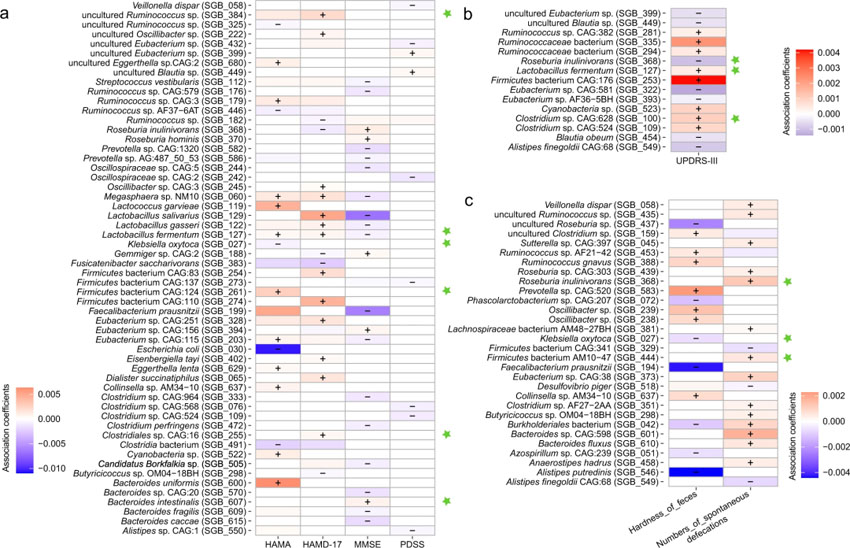
图5 帕金森患者的粪便物种水平基因组箱(SGBs)与帕金森相关症状的临床指标之间的相关性。肠道菌群与(a)帕金森患者的精神状态(以汉密尔顿焦虑量表、汉密尔顿抑郁量表17和简易精神状态检查为代表)和睡眠质量(以PDSS为代表)的相关性。(b)帕金森患者的疾病进展(统一帕金森病分级III)。(c)便秘相关症状(粪便硬度和自发排便次数)。帕金森病的差异SGBs用绿色星号标记。“+”和“-”分别代表正相关和负相关。(原文中图3)
4. Probio-M8调节肠道微生物相关的神经活性模块
本研究根据Valles-Colomer先前描述的方法,分析了肠道微生物编码的神经活性化合物的代谢模块。共鉴定到48个模块,其中类胡萝卜素依赖酶,S-腺苷甲硫氨酸(SAM)合成,谷氨酸合成II,醋酸合成I和谷氨酸合成I是含量最多的5个代谢模块。为了确定Probio-M8对肠道微生物群相关神经活性化合物的特异性作用,我们分析了益生菌组和安慰剂组之间差异丰富的代谢模块。从29种益生菌应答型SGBs中可鉴定出30种代谢模块(图5a)。摄入M8后增加了SGBs编码模块的多样性,如参与色氨酸降解、GABA、短链脂肪酸(异戊酸、丁酸和丙酸)和次级胆汁酸生物合成,安慰剂组有着更高的SGBs编码模块多样性,如参与维生素K2合成、色氨酸合成和肌醇降解。此外,在干预三个月后,益生菌组患者的SGBs有着更多的PUFAs合成通路。有趣的是,与益生菌组相比,安慰剂组患者参与GABA合成的SGBs较少,但编码GABA降解的SGBs较多(图5a)。
5. Probio-M8促进肠道菌群生物活性代谢物的生成
利用MelonnPan预测肠道微生物的代谢物,共识别到80种代谢物,脱氧胆酰和谷氨酸是含量最高的。Procrustes分析是一种数据降维后将多组学数据集显示在低维空间的统计方法,在微生物组学和代谢组学研究中多被用于评价数据集之间的内聚性。通过Procrustes分析以评估肠道微生物组与预测代谢组间的一致性,发现两个数据集之间存在正相关的联系(correlation=0.329,P=0.001,图5b)。通过PCoA分析评估患者肠道代谢组的变化,发现基于时间两组之间无聚类现象(图5c,5d)。然而,益生菌组的肠道菌群结构发生了显著变化(1个月时与基线相比,P=0.233,R=0.006;3个月时与基线相比,P=0.003,R=0.075;图4d),而安慰剂组(图5c)无明显变化。
为了确定益生菌调节的肠道微生物活性代谢物谱,我们分析了在1个月和3个月时Probio-M8组与安慰剂组之间的差异代谢物。在益生菌干预一个月后,只鉴定到一种差异预测代谢物,即硬脂酰乙醇酰胺;在1个月时,益生菌组的硬脂酰乙醇酰胺含量显著高于安慰剂组(P=0.05)。在3个月时有着更加显著的变化,且11个预测代谢物中都发现了这种变化。3个月时,与安慰剂组相比,Probio-M8组二甲基精氨酸(ADMA)、胆红素、胆酸、鹅去氧胆酸、肌酸、红血球酸和三甲基赖氨酸的丰度显著下降(P<0.05;图5e),而C20:4肉碱、胆酮、N-乙酰谷氨酸和尿胆素的丰度显著升高。
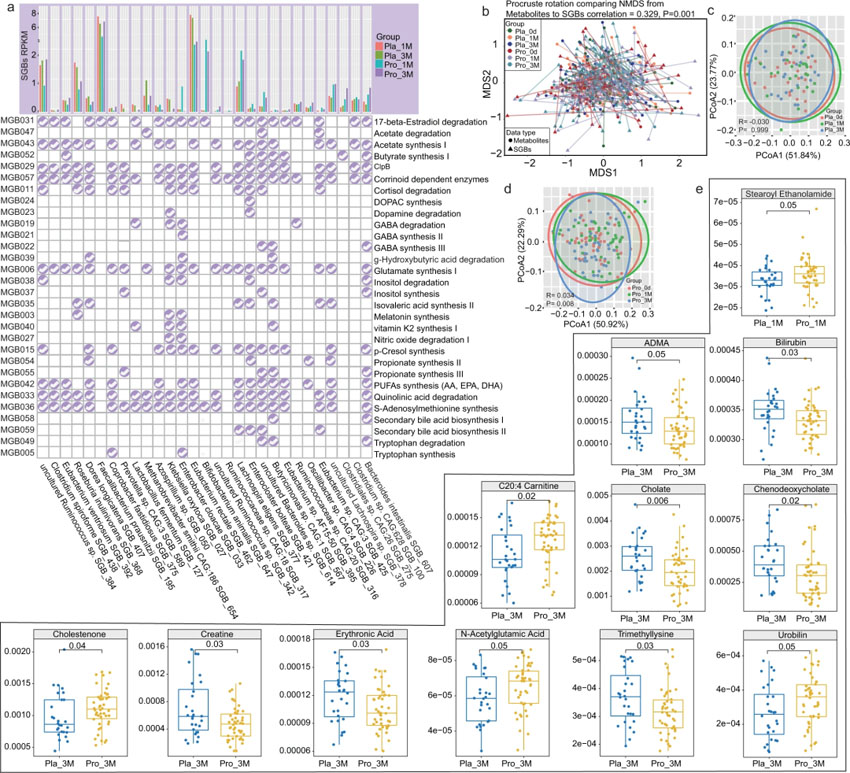
图6 干预1个月和3个月后肠道代谢模块(GMMs)和预测代谢产物的概况。(a)在probio-M8组(Pro)和安慰剂组(Pla)之间的显著差异物种水平基因组箱(SGBs)中选定的GMMs(与帕金森病相关的发展、病理生理和免疫相关)的分布。(b)在第0天(0d)、1个月(1M)和3个月(3M)时对probio-M8组和安慰剂组之间的预测微生物组和代谢组进行Procrustes分析,发现微生物组和代谢组之间存在正相关关系(correlation=0.329;P=0.001)。(c),(d)Probio-M8组和安慰剂组在第0天、1个月和3个月的主坐标分析(PCoA)图和Adonis检验展示了预测的生物活性代谢产物的变化。代表不同时间点的个体样本的符号用不同的颜色表示。采用Adonis检验评价组间差异。(e)对Probio-M8辅助治疗有反应的预测的差异生物活性代谢物含量的箱线图,P<0.05被认为具有统计学意义。箱线图要素:中线、中位数;箱限,上、下四分位;晶须,1.5倍四分位范围;点,离群值。(原文中图4)
6. Probio-M8调节PD患者的血清短链脂肪酸和神经递质
为了验证MelonnPan和Procrustes的分析结果,采用GC-MS/MS测定干预前和干预期间血清SCFAs和神经递质的水平。但是由于成本的原因,仅分析了26份血清样本(每组随机抽取血清13份)。所有样本中共识别到7种短链脂肪酸(包括醋酸、丙酸、异丁酸、丁酸、异戊酸、戊酸、庚酸)和12种神经递质(包括乙酰胆碱、胆碱、谷氨酸、苯丙氨酸、犬尿氨酸、酪氨酸、组氨酸、精氨酸、血清素、色氨酸、3-羟基酪胺、谷氨酰胺)。在1个月和3个月时,益生菌组患者的血清乙酸浓度显著升高(P<0.05;图6a,图6b;附表9)。在1个月时,与安慰剂组相比,益生菌组患者的血清样品中多巴胺(3-hydroxytyramine)含量显著升高(P=0.05;图6c;附表9),而谷氨酰胺、色氨酸浓度(图6d,图6e;附表9)显著降低。不幸的是,另外14种神经递质在两组和时间点之间并无显著差异。这些结果表明,Probio-M8辅助治疗可调节PD患者的血清SCFAs和神经递质。
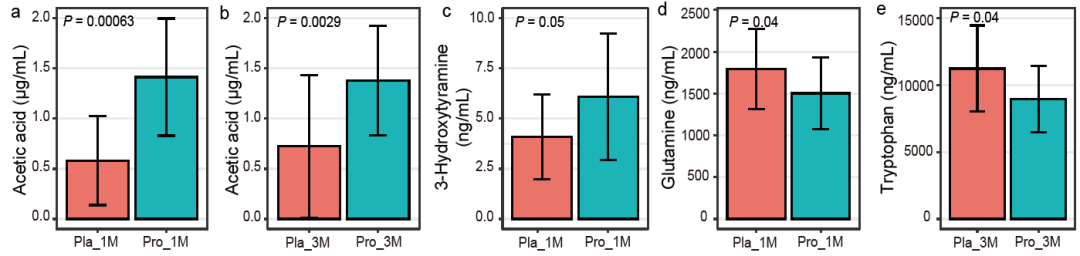
图7 Probio-M8组和安慰剂组的血清短链脂肪酸(SCFAs)和神经递质的差异。(a)-(e)益生菌组和安慰剂组在1个月和3个月时的血清短链脂肪酸和神经递质之间的显著性差异,误差条代表SD;P<0.05为存在差异(具有统计学意义)。(原文中图5a-e)
不良事件
在试验期间,与安慰剂组相比,益生菌组的患者未出现任何严重程度的不良事件,证明Probio-M8与常规药物联合治疗帕金森的临床安全性。
讨论
本随机双盲对照试验表明Probio-M8能够显著缓解帕金森患者的疾病严重程度,同时能够改善帕金森的相关不良症状(如睡眠质量差、精神状态、排便等),从而提高帕金森患者的生活质量。疾病的改善伴随着服用益生菌后引起的患者肠道菌群的改变。益生菌驱动帕金森相关症状的改善,如腹痛和腹胀缓解、布里斯托尔评分下降、每周自发排便次数增加、超敏C反应蛋白增加、丙二醛、谷胱甘肽及胰岛素代谢下降,这与先前的报道一致;然而,据我们所知,本研究首次报道了益生菌辅助治疗对帕金森患者非运动性症状的影响,同时从宿主肠道菌群和血清代谢组的角度探讨了益生菌的作用机制。
我们的研究表明,服用帕金森病药物(苄丝肼和多巴胺激动剂)和益生菌显著提高了患者的UPDRS-III评分,先前的研究中也报道过类似的结果。益生菌改善帕金森相关症状的一个机制可能是酪氨酸羟化酶活性的增加,这也是L-酪氨酸-L-多巴转化的关键因素。通过文献检索,我们发现只有6项研究探究了益生菌给药或益生菌发酵乳对帕金森患者的有益作用,其中4项研究表明益生菌的摄入提高了Bristol评分,改善了排便习惯。与预期结果一致,我们的数据表明,Probio-M8能够改善粪便的硬度、每周自发排便和完全排尽的次数、排便困难、排便不完全、人工辅助排便、排便次数、大便硬化次数以及PA-CQL评分。除了便秘相关的症状外,抑郁、焦虑、睡眠障碍、认知障碍等非运动性症状也会给许多帕金森患者带来很大的痛苦。据报道,益生菌辅助治疗可通过调节肠道菌群来缓解神经系统问题或疾病的症状,如焦虑和阿尔茨海默病。我们之前的研究表明,摄入益生菌12周可以通过益生菌诱导的肠道菌群多样性和功能宏基因组潜能的变化,从而缓解成年人的压力或焦虑等相关症状,这也表明肠道菌群及其环境对神经系统疾病的发展和严重程度有着重要的影响。因此,益生菌辅助治疗可作为一种具有前景的方法通过调节肠道微生物来缓解上述疾病相关问题。
在干预过程中或干预后,粪便微生物的多样性和结构没有明显变化。较高的肠道菌群多样性通常被认为是一种健康的生理状态,而较低的肠道菌群多样性通常与不健康的条件相关,如肠易激综合征和轻度认知障碍。然而,在帕金森患者中粪便硬度低较为常见,已有报道表明这与物种多样性高相关。同时,在先前的一项为期两年的帕金森患者的肠道菌群调查中发现不同时间点的Shannon指数和beta多样性无显著差异,这与我们的结果一致。因此,益生菌驱动的肠道菌群调控似乎不是表现在微生物的多样性和结构水平上,而在于肠道中负责特定功能的关键物种。例如,双歧杆菌一直被认为是帕金森患者的致病菌,因为它们被发现与帕金森的病理有关。然而,在本研究中发现,益生菌干预后动物双歧杆菌的相对丰度显著增加,并伴有临床症状的缓解,提示动物双歧杆菌的增加可能会减轻帕金森的相关症状。
据报道,与健康人群相比,帕金森患者的肠道菌群碳水化合物发酵和丁酸合成能力降低,蛋白水解发酵能力增加。厚壁菌门中的一些类群是碳水化合物发酵和丁酸合成的主要分子,如丁酸弧菌和梭杆菌集群IV和XIV。我们的研究发现摄入益生菌后,厚壁菌门(Butyricimonas sp. CAG:1、Lachnospira eligens、Clostridiales sp. CAG:26等)的SGBs增加。益生菌干预后,一些参与合成短链脂肪酸(丁酸、异戊酸、丙酸)的SGBs增加。有研究表明,拟杆菌类是γ-氨基丁酸的生产者,它们的相对丰度与抑郁症相关的脑信号呈负相关。有趣的是,我们的数据显示益生菌组有着更多的γ-氨基丁酸合成模块编码的SGBs;并且在Probio-M8组中发现了更多的拟杆菌属(Bacteroides testinalis),这与MMSE评分增加有关。此外,我们的数据还表明,在干预后,安慰剂组中发现了更多代表普雷沃氏菌和乳酸杆菌的SGBs。帕金森患者的普氏菌属显著增加,该菌在黏液层糖蛋白代谢、肠屏障通透性、炎症等方面发挥着重要作用。一些乳酸杆菌可产生特定的酶,在左旋多巴到达大脑之前将其转化为多巴胺,从而降低药物疗效,增加临床疗效所需的剂量。我们的结果表明,安慰剂组发酵乳杆菌的丰度与较差的精神状态(特征为HAMA和HAMD得分较高;MMSE得分较低)和病情严重(以UPDRS得分较高为特征)显著相关。此外,一些神经炎症相关病原体在益生菌干预后显著减少,如P. distasonis、Evtepia gabavorous和K. oxytoca。其中,P. distasonis与海马功能呈负相关,而K. oxytoca可诱导小鼠焦虑和结肠炎,并通过产生脂多糖和肠毒素从而引起神经元凋亡。本研究发现在帕金森患者中,K. oxytoca和粪便硬度呈显著负相关。因此,Probio-M8的临床缓解作用可能与帕金森患者的特异性肠道菌群调节相关。
肠道菌群的改变伴随着肠道代谢组的巨大变化。计算各组预测代谢物的变化,在3个时间点(0天、1个月、3个月;P=0.008)益生菌组显著变化,而安慰剂组无显著变化(P=0.999),表明Probio-M8对肠道微生物代谢物的调节作用更明显。先前有研究表明,脂质代谢的改变与帕金森患者的肉碱穿梭、鞘脂代谢、花生四烯酸代谢和脂肪酸生物合成有关。我们的研究还发现益生菌驱动了脂质代谢调节,表现为粪便中预期的硬脂酰乙醇酰胺和C20:4肉碱水平升高,同时血清乙酸水平显著升高。硬脂酰乙醇酰胺可抑制神经酰胺转化为鞘氨醇,而鞘氨醇已被报道为帕金森患者的神经退行性化合物。此外,一种秀丽隐杆线虫的帕金森模型表明,益生菌可以改变宿主鞘脂代谢,并抑制α突触核蛋白聚集。据报道,与健康人相比,帕金森患者的肉碱含量较低。双歧杆菌是由肠道中的乙酸产生的,在益生菌干预过程中观察到的动物双歧杆菌丰度升高可能导致血清乙酸的增加。血浆乙酸浓度与结肠运输时间呈负相关,这与我们观察到的益生菌治疗增加每周自发排便次数一致。另一类微生物神经活性代谢物氨基酸和胆汁酸也构成了沿肠脑轴的信息流。我们的数据表明,Probio-M8组胆甾酮和N-乙酰谷氨酸的预测水平升高,而安慰剂组胆酸、鹅脱氧胆酸、三甲基赖氨酸和不对称二甲基精氨酸显著升高。胆酸和鹅脱氧胆酸是精氨酸生物合成途径的第一个中间体;不对称二甲基精氨酸通过抑制一氧化氮合成酶来降低一氧化氮。Faraco等人表明补充L-精氨酸可通过促进NO的产生逆转小鼠的认知功能障碍。胆甾酮是胆固醇的氧化产物,可由拟杆菌等细菌产生。到目前为止,关于胆甾酮对健康的影响知之甚少,但有少量研究表明胆甾酮与新生儿的快速生长呈正相关。此外,胆甾酮也可用于治疗幽门螺杆菌感染者,但可能影响免疫系统功能。
最后,我们发现Probio-M8组血清多巴水平在1个月时升高。多巴胺减少是帕金森病病理改变的主要原因。人体多巴胺由L-苯丙氨酸(L-Phe)生成,先转化为酪氨酸(Tyr),再转化为左旋多巴(L-dopa),再转化为多巴胺。然而,只有左旋多巴(而不是多巴胺)可以通过血脑屏障缓解帕金森的相关症状。Probio-M8治疗一个月后血清多巴水平升高,这表明可能有更多的L-多巴进入循环系统,提示摄入Probio-M8可以提高帕金森患者处方药物的临床疗效。然而,这种推论还需要进一步的实验验证。
结论
本研究进行了为期3个月的随机对照临床实验,以探讨益生菌辅助治疗对帕金森患者的有益作用。研究结果表明,益生菌Probio-M8能够改善帕金森病的严重程度,并且改善了患者的焦虑和抑郁状态。其缓解症状的可能机制是通过Probio-M8调节患者的肠道菌群,进一步调节宿主的脂质、短链脂肪酸和神经递质代谢,从而提高患者血清多巴胺水平(图7)。本研究结果为治疗帕金森病提供了新的选择。
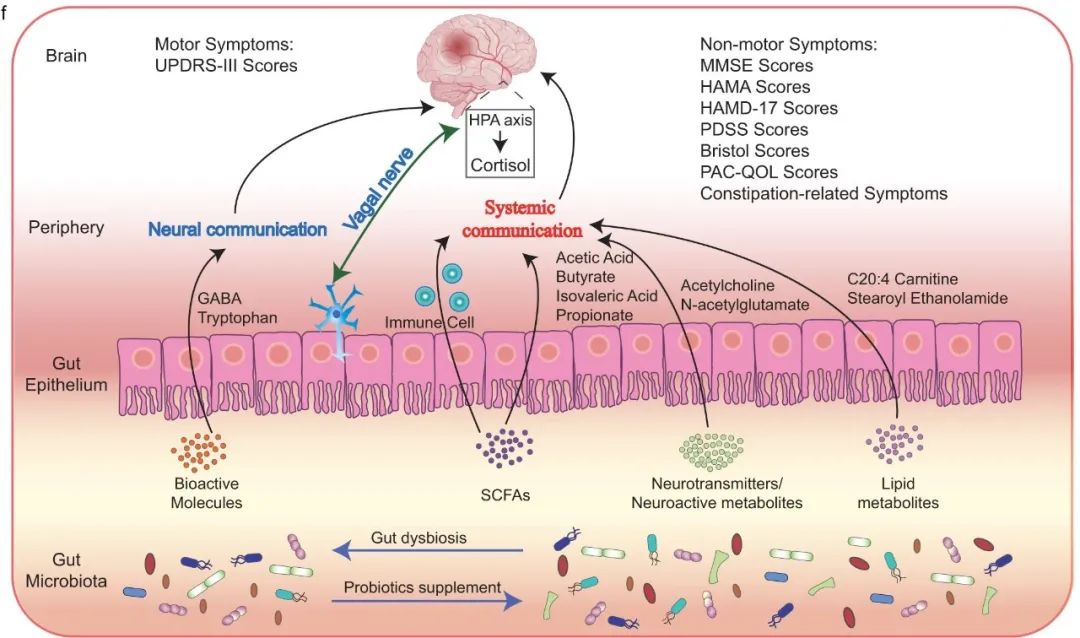
图8 益生菌驱动调节帕金森病患者肠脑轴途径的模型。图中展示了调节肠脑轴和宿主反应的关键益生菌驱动途径。UPDRS-III、MMSE、HAMA、HAMD-17、PDSS、PACQOL分别代表统一帕金森病量表III、细微精神状态检查量表、汉密尔顿焦虑量表、汉密尔顿抑郁量表-17、帕金森病睡眠量表、便秘生活质量评估。GABA和SCFAs分别代表γ-氨基丁酸和短链脂肪酸。(原文中图5f)
原文链接:https://www.nature.com/articles/s41531-022-00327-6
免责声明:本文仅代表作者个人观点,与中国益生菌网无关。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
版权声明
1.本站部分转载的文章非原创,其版权和文责属于原作者。2.本网所有转载文章、链接及图片系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,对可以提供充分证据的侵权信息,bio149将在确认后12小时内删除。3.欢迎用户投递原创文章至86371366@qq.com,经审核后发布到首页,其版权和文责属于投递者。







