动物所揭示“肠道菌群肠—脑”互作调控动物对寒冷环境的适应机制
时间:2019-09-04 来源:中国生物技术网 作者:bio149发布 浏览次数:2207冬季的严寒和食物短缺对于温带地区非冬眠哺乳动物的生存是极大的挑战。恒温动物维持高而恒定的体温需要付出很高的代价。褐色脂肪组织(brown adipose tissue, BAT)产热(非颤抖性产热)是一种高效迅速的产热方式,受交感神经支配,在小型哺乳动物(包括冬眠动物)的体温调节中发挥关键作用。当动物受到寒冷等信号刺激时,支配BAT的交感神经末梢释放去甲肾上腺素,去甲肾上腺素通过作用于BAT细胞膜上的β3肾上腺素能受体,激活蛋白激酶A信号通路,即cAMP-PKA-pCREB通路,诱导线粒体内膜上的产热蛋白——解偶联蛋白1(uncoupling protein 1, UCP1)的表达,提高非颤抖性产热能力,维持恒定的体温。动物体内的肠道微生物是否参与了动物的体温调节和代谢产热过程呢?
中国科学院动物研究所王德华研究组曾发现,对于动物越冬具有重要意义的聚群行为(huddling)可提高布氏田鼠(Lasiopodomys brandtii)肠道菌群的丰富度和多样性,增加有益菌而降低有害菌的数量,提高代谢产物短链脂肪酸的含量,为宿主提供能量来源,通过菌群移植等多个实验揭示了肠道菌群介导聚群行为的能量节省机制,为理解肠道菌群与宿主的协同进化提供了新的视角(Zhang et al., 2018, Microbiome 6: 103)。
肠道菌群对于小型哺乳动物的越冬具有重要作用。该研究组最新的一项研究,进一步揭示了肠道菌群与宿主之间相互作用调控动物对寒冷环境的代谢适应机制。研究发现,布氏田鼠在低温环境下摄食量和产热增加,同时肠道中单胺类神经递质、增食类激素(ghrelin)、短链脂肪酸含量也明显增加,肠道菌群结构有明显改变。通过配对饲喂(pair-feeding)实验(即对低温暴露的动物饲喂与常温对照组相同的食物量),验证了低温导致了肠道菌群的改变,而非摄食量增加所致。那么,肠道菌群是如何影响动物的产热调节呢?通过菌群移植实验,结合药理学实验(注射β3肾上腺素能受体拮抗剂或PKA信号通路阻断剂),确证了低温菌群通过激活去甲肾上腺素——PKA信号通路,促进了产热蛋白UCP1的表达。此外,根据负反馈调控理论,进一步验证了宿主的神经递质去甲肾上腺素的增加反过来也会对肠道菌群的结构产生调节作用。这项研究表明“肠道菌群—肠—脑”互作调控动物对寒冷环境的适应能力,揭示了非冬眠小型哺乳动物与其共生菌群的协同进化机制。
这项研究工作以The microbiota-gut-brain interaction in regulating host metabolic adaptation to cold in male Brandt’s voles (Lasiopodomys brandtii) 为题于8月27日在线发表于the ISME Journal上。动物所农业虫害鼠害综合治理研究国家重点实验室动物生理生态学研究组博士研究生薄亭贝和副研究员张学英为共同第一作者,王德华和张学英为共同通讯作者。该研究得到国家自然科学基金面上项目和北京市自然科学基金面上项目的资助。
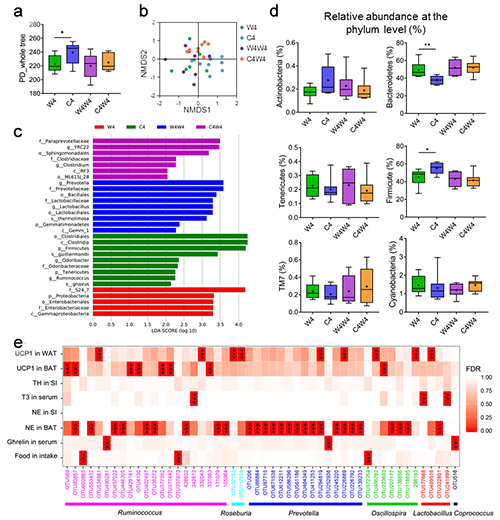
图1 低温改变布氏田鼠的肠道菌群结构和调节产热功能。(a) Alpha多样性;(b) 基于未加权Unifrac距离算法的NMDS图;(c) LEfSe分析鉴定不同组中的差异标志菌;(d) 门级水平上的相对丰度;(e) 特定OTU与生理指标的相关关系。
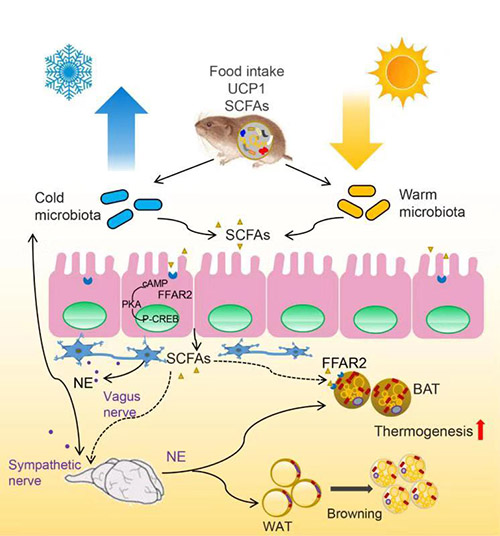
图2 肠道微生物—肠—脑互作调控动物在寒冷环境的代谢和产热
免责声明:本文仅代表作者个人观点,与中国益生菌网无关。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
版权声明
1.本站部分转载的文章非原创,其版权和文责属于原作者。2.本网所有转载文章、链接及图片系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,对可以提供充分证据的侵权信息,bio149将在确认后12小时内删除。3.欢迎用户投递原创文章至86371366@qq.com,经审核后发布到首页,其版权和文责属于投递者。







