干酪乳酪杆菌Zhang对低铁饲粮小鼠铁状况、免疫和肠道菌群的影响
时间:2022-01-09 来源:微生态 作者:bio149发布 浏览次数:2431
本实验将小鼠随机分为4组(每组8只):CT组(对照饮食)、LI组(低铁饮食)、CTL组(对照饮食并给予LCZ)、LIL组(低铁饮食并给予LCZ)。8周后进行粪便和血液采集,后一天解剖小鼠,用干净的滤纸吸干肝脏和脾脏,记录重量。用AU480测定血清铁(SI)和血清总铁结合力(TIBC),Qiagen试剂盒进行DNA提取,建库后使用Illumina HiSeq进行测序。使用HUMAnN2软件对原始测序数据进行处理和物种注释。利用Chao1指数和Shannon多样性指数分别估算了物种丰富度和均匀度。采用ProcartaPlex™免疫分析技术,对小鼠血清中的免疫因子进行定量鉴定。

虽然大量的研究已经揭示了膳食缺铁的生理和神经后果,但需要进一步的研究来评估其对肠道菌群的影响,而且关于低铁饮食者肠道菌群变化的基础研究还相对有限。LCZ能够很好的在人类胃肠道中定植,可调节免疫反应和肠道菌群组成,并能增强抗炎和抗氧化作用;还提高了血清和肾脏中短链脂肪酸(SCFAs)和烟酰胺的水平,从而减少肾脏炎症和肾小管上皮细胞的损伤。而LCZ尚未在低铁饮食的人体或动物中进行研究。
本研究旨在探讨LCZ对低铁饮食小鼠铁状态、微生物群和免疫力的潜在保护作用,提高我们对低铁饮食对肠道菌群影响的认知,以及LCZ在这种情况下是否能发挥有益作用的理解。
实验结果
1.血清铁相关生化指标及器官系数
LI组SI显著高于CT组(CT组:11.74±1.61μmol/L,LI组:19.04±4.19 μmol/L,P<0.05),LIL组低于CT组,但差异无统计学意义(LI组:19.04±4.19 μmol/L,LIL组:16.86±3.61 μmol/L,P>0.05;图2B)。LI组的TIBC明显高于CT组(CT组:100.33±3.52 μmol/L,LI组:108.81±7.04 μmol/L,P<0.01),而LIL组明显低于LI组(LI组:108.81±7.04μmol/L,LIL组:95.87±3.80 μmol/L,P<0.05;图2C)。CT组与CTL组之间(CT组:100.33±3.52 μmol/L,CTL组:98.24±10.25 μmol/L,P> 0.05)、CTL组与LIL组之间(CTL组:98.24±10.25 μmol/L,LIL组:95.87±3.80 μmol/L,P>0.05)TIBC均无显著差异。各组肝、脾器官系数均无统计学差异(图S1)。
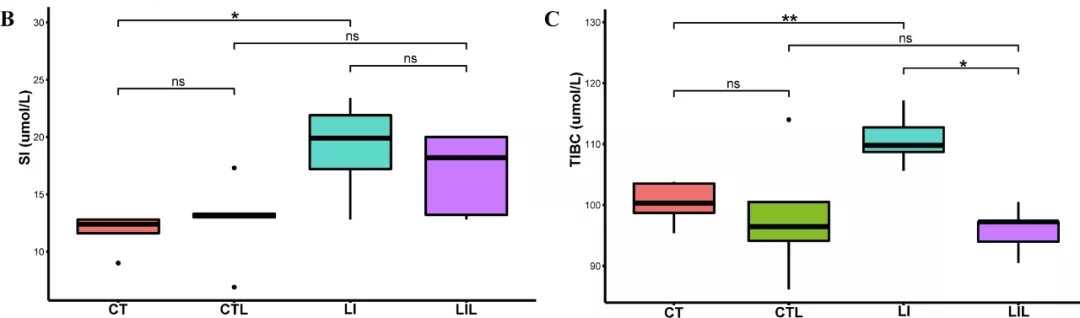
图2 血清铁状态分析。各组血清中铁含量(B)及总铁结合能力(C)对比。CT(对照饮食),LI(低铁饮食),CTL(对照饮食并给予LCZ)和LIL(低铁饮食并给予LCZ)。*代表P<0.05;* * 代表P<0.01。ns:不显著。(原文图1B、C)
2.宏基因组多样性
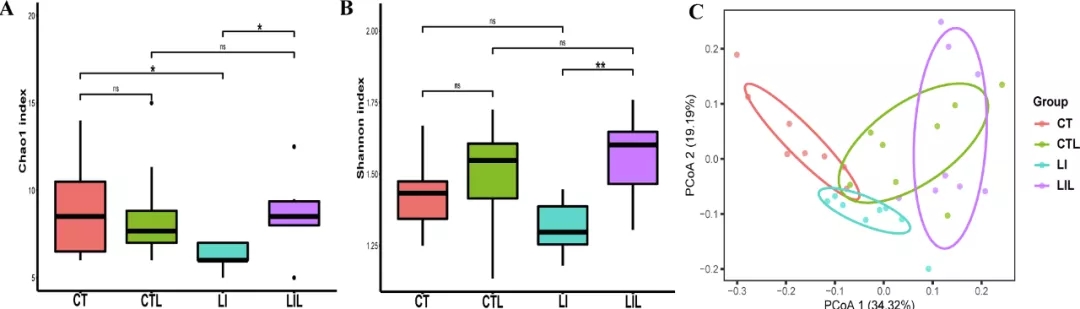
采用Shannon多样性指数和Chao1指数评估第8周4组粪便微生物群的多样性和丰富度。LI组的Chao1指数显著低于CT组(P<0.05),而LIL组显著高于LI组(P<0.05;图3A)。CT组与CTL组(P>0.05)、CTL组与LIL组(P>0.05)的Chao1指数无显著性差异。LI组的Shannon指数略低于CT组(P>0.05)。而LIL组明显高于LI组(P<0.01;图3B)。CT组与CTL组(P>0.05),CTL组与LIL组(P>0.05)之间,Chao1指数无显著性差异。结果表明,低铁饮食降低了小鼠肠道菌群多样性,补充LCZ可以维持其多样性。
在PCoA评分图上(Bray-Curtis距离;图3C),各组间的微生物群结构差异显著(CT组和CTL组R=0.47,P<0.001;CT组和LI组R=0.56,P<0.001;LI组和LIL组R=0.41,P<0.001),ANOSIM结果也支持各组间粪便微生物群结构存在显著性差异。
在种水平上(图4C-H),CTL组普通拟杆菌数量少于CT组,而CT组和CTL组之间未见这种差异(CT组:29.02±3.86%,CTL组:23.26±8.87,P>0.05)。LI组高于CT组,但差异无统计学意义(CT组:29.02±3.86%,LI组:32.56±13.00%,P>0.05)。LIL组明显低于LI组(LI组:32.56±13.00%,LIL组:20.55±6.92%,P<0.05)。
LI组肠拟杆菌数量明显多于对照组(CT组:0.025±0.01%,LI组:2.63±2.00%,P<0.001)。LIL组也明显多于CTL组(LIL组:0.43±0.41%,CTL组:0.07±0.05%,P<0.05)。而LIL组明显低于LI组(LI组:2.63±2.00%,LIL组:0.43±0.41%,P<0.05)。
LI组Alistipes unclassified数量明显多于CT组(CT组:3.94±3.06%,LI组:7.53±3.34%,P<0.05),和LI组相比LIL组的该分类群也明显增多(LI组:7.53±3.34%,LIL:3.48±1.98%;P<0.05)。
在LCZ干预组中,仅检出Parabacteroides distasonis(CTL:0.48±0.40%, LIL:0.94±0.58%,CT:0,LI:0)和Parabacteroides unclassified(TL:8.52±6.22%,LIL:13.31±12.03%,CT:0,LI:0)。
LI组Parabacteroides goldsteinii数量明显高于CT组(CT组:1.40±0.33%,LI组:12.00±10.33%,P<0.001)。LIL组明显多于CTL组(LIL组:5.24±1.89%,CTL组:1.84±1.29%,P<0.001),但显著低于LI组(LI组:12.00±10.33%,LIL组:5.24±1.89%,P <0.05)。表明低铁饮食可能增加粪便中Parabacteroides goldsteinii,而LCZ则可抵消这一影响。
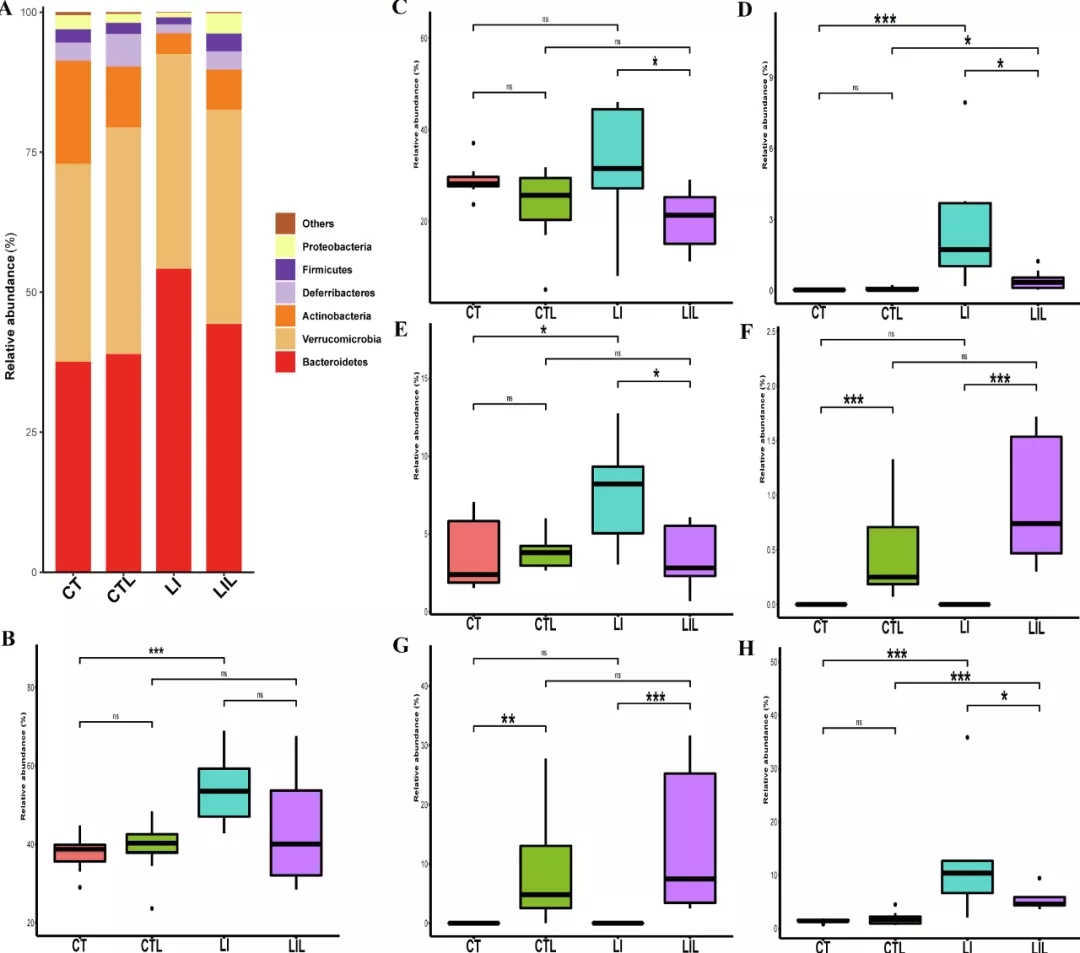
图4 粪便微生物群在门和种水平的分布(n=8)。(A)门水平的粪便微生物群。(B)拟杆菌,(C)普通拟杆菌,(D)肠拟杆菌,(E)Alistipes unclassified,(F)Parabacteroides distasonis,(G)Parabacteroides unclassified 和(H)Parabacteroides goldsteinii相关丰度。CT(对照饮食),LI(低铁饮食),CTL(对照饮食并给予LCZ)和LIL(低铁饮食并给予LCZ)。*代表P<0.05;**代表P <0.01,***代表P <0.001。ns:不显著。(原文图3)
4.粪便微生物的共发生网络
通过构建各组共发生网络,分析粪便微生物群落细菌间相互作用模式(基于Spearman相关系数)。CT、CTL、LI和LIL组的集合群落共发生网络分别包含64条边(代表34个相互作用的种/株)、63条边(代表34个相互作用的种/株)、66条边(代表42个相互作用的种/株)和76条边(代表41个相互作用的种/株)(图5)。
与CT组相比,CTL组副拟杆菌的相关聚类较大(6.35%),拟杆菌的相关聚类较小(3.17%);LI组中拟杆菌(3.03%)、副拟杆菌(1.51%)的相关聚类较小。与LI组相比,LIL组中副拟杆菌和拟杆菌的比例更大,即7.89%(LI组为4.55%)。在科水平上,LCZ干预的正常饮食(CTL:11.11%)和低铁饮食组(LIL:9.21%)中,与CT和LI组(CT:6.25%,LI:6.06%)相比,乳酸杆菌相关聚类比例更大。
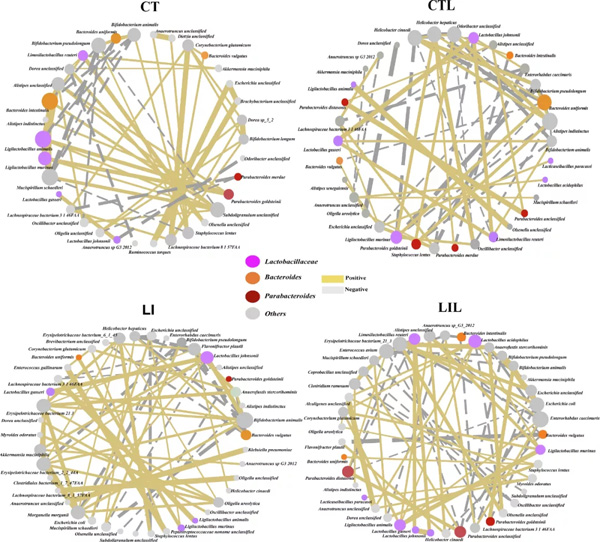
图5 Spearman的相关网络分析显示粪便微生物在CT(对照饮食,n=8),LI(低铁饮食,n=8),CTL(对照饮食并给予LCZ,n=8)和LIL(低铁饮食并给予LCZ,n=8)上的物种水平相互作用。不同颜色的节点代表被检测物种的属。边缘的样式表示正相关(黄色实线)和负相关(灰色虚线),线粗表示相关强度。仅显示显著相关(截止阈值:Spearman系数> 0.7,P < 0.05;原文图4)。
5.微生物类群与功能宏基因组之间的相关性网络
铁在肠道菌群的代谢调节中起着重要的作用,特别是氨基酸和维生素的代谢。与CT组相比,LI组L-组氨酸的生物合成途径(图6A)明显降低(P <0.05)。与CTL组相比,LIL组的相同通路显著富集(P<0.05)。与LIL组相比,CTL组黄素生物合成途径显著富集(P<0.01)。低铁饮食可能与肠道菌群中L-组氨酸生物合成相关基因的减少有关,摄入LCZ可能会抵抗这种不良反应影响,进而维持维生素B代谢的稳定水平。LI组黄素生物合成相关基因的表达水平明显高于CT组(图6B;P<0.01)。LIL组黄素生物合成相关基因水平显著低于CTL组(P<0.001),说明低铁饮食可以改变其生物合成。与LI组相比,LIL组代表黄素生物合成的基因显著增加(P<0.05)。其他检测到的细菌对氨基酸和维生素的代谢途径的水平如图S2所示。
L-组氨酸生物合成相关途径的基因丰度与肠拟杆菌呈显著负相关(P<0.001,r=-0.58)。黄素的生物合成与肠拟杆菌(P<0.01,r=-0.53)和Parabacteroides goldsteinii呈显著负相关(P<0.001,r=-0.70;图6C)。
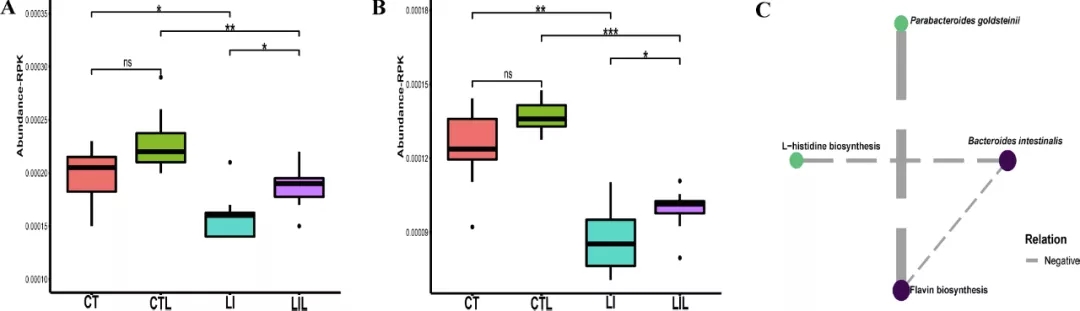
图6 (A)L-组氨酸生物合成(n=8)、(B)黄素生物合成(n=8)途径的基因丰度。(C)细菌种类与这两种途径的Spearman相关性分析,截止阈值:Spearman系数> 0.5,P<0.05。边缘样式(灰色虚线)表示负相关,线粗表示相关强度。CT(对照饮食),LI(低铁饮食),CTL(对照饮食并给予LCZ)和LIL(低铁饮食并给予LCZ)。*代表P<0.05,**代表P<0.01,***代表P<0.001。ns:不显著。(原文图5)
6.血清细胞因子的变化
饮食模式可能直接影响免疫系统,膳食缺铁与轻度炎症有关。因此,为了解铁缺乏和免疫稳态之间的关系,在饮食干预结束时测了36种细胞因子的水平。LI组IL-18明显高于CT组(CT组:453.39±127.25 pg/ml,LI组:660.97±96.68pg/ml,P<0.05;图7A);LIL组(376.35±102.66 pg/ml)显著低于LI组(P<0.01)。CT组与CTL组间无显著性差异(P>0.05)。各组间与IL-18密切相关的细胞因子,包括IFN-gamma、GM-CSF、IL-13、IL-1alpha和IL-1beta,均无显著性差异(P>0.05;图7B-7F)。LI组的IFN-gamma、GM-CSF和IL-1beta水平在数值上高于CT组(图7B-7F)。
对细胞因子与显著调节的物种进行相关性分析(图7G)。IL-18与Parabacteroides distasonis呈显著负相关(P<0.05,r=-0.53)。GM-CSF与Alistipes unclassified呈显著正相关(P<0.01,r=0.65)。IFN-gamma与肠拟杆菌(P<0.05,r=0.52)和Parabacteroides goldsteinii呈显著正相关(P<0.001,r=0.67)。
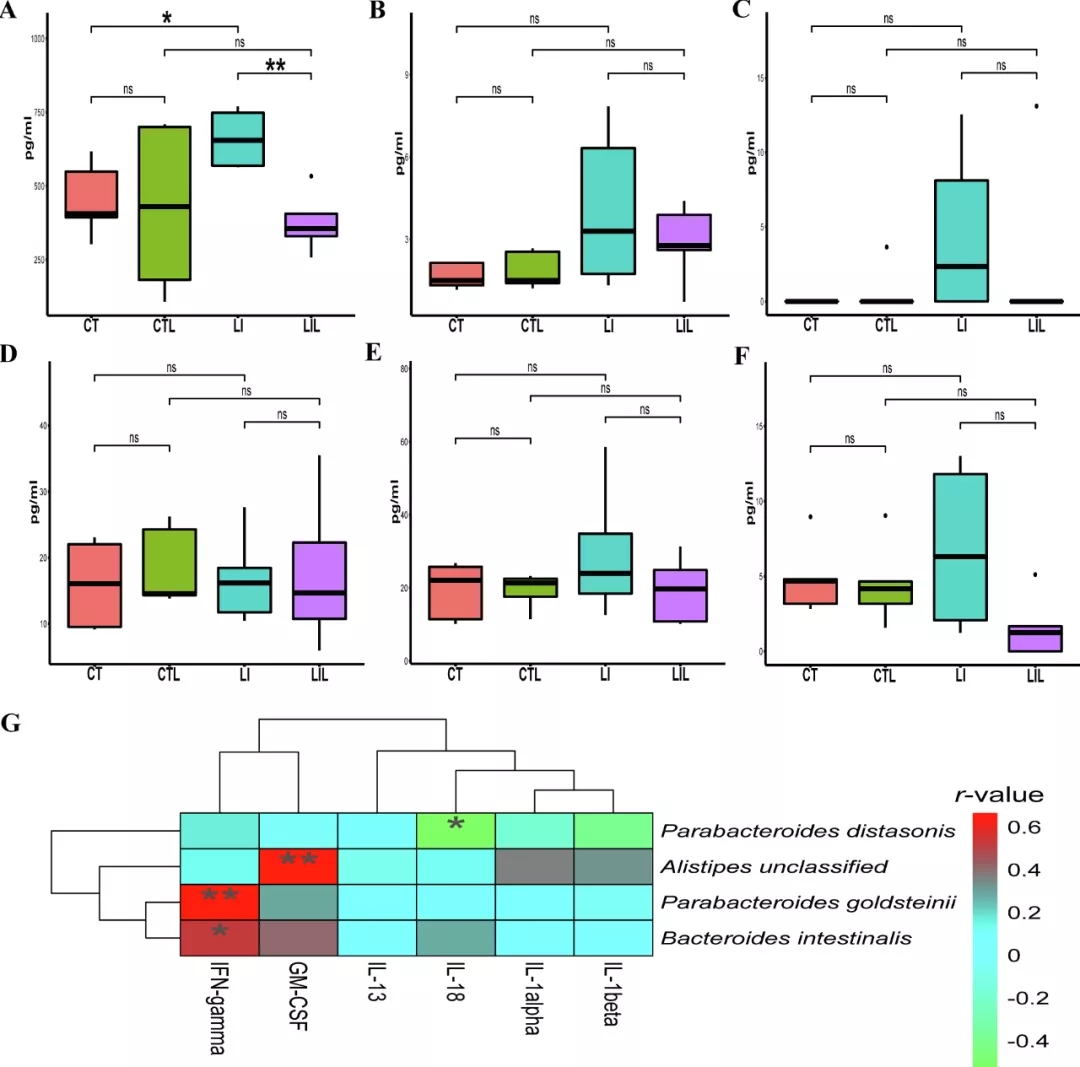
图7 细胞因子及其与肠道中差异菌种的相关性(n=8)。(A)白细胞介素(IL)-18、(B)干扰素(IFN)-gamma、(C)粒细胞-巨噬细胞菌落刺激因子(GM-CSF)、(D)IL-13、(E)IL-1alpha和(F)IL-1alpha的血清水平。(G)免疫因子与细菌种类的相关性分析(截止阈值:Spearman系数>0.5,P<0.05)。CT(对照饮食),LI(低铁饮食),CTL(对照饮食并给予LCZ)和LIL(低铁饮食并给予LCZ)。*代表P<0.05,**代表P<0.01。ns:不显著。(原文图6)
采用宏基因组学分析正常或低铁饮食加或不加益生菌处理的粪便微生物群的差异。LI组(接受低铁饮食)的微生物群结构与CT组(接受正常饮食)有显著差异,其特征为微生物多样性较低。肠道微生物多样性被认为是反映宿主健康状况的一个指标,因为其减少与许多疾病密切相关。相比之下,LIL组(接受LCZ)的微生物多样性高于LI组,根据PCoA和ANOSIM的结果,其微生物群结构也存在显著差异。
血清TIBC是一种常用于评估身体铁质状态的指标。实验中,只喂食低铁饮食的小鼠TIBC水平明显高于对照组小鼠。TIBC的增加在各种缺铁性贫血和增强转铁蛋白合成中更为常见。低铁饲粮中添加LCZ的小鼠血清TIBC水平明显低于低铁饲粮组,但对照组与低铁饲粮中益生菌组的TIBC水平无显著差异。补充LCZ对低铁饮食引起的TIBC改变有一定的调节作用。进一步分析类群之间的相关性。与低铁组相比,LCZ组粪便微生物群中的乳酸菌科形成了一个更占优势的簇,与其他细菌相比有更显著的相关性。表明在低铁饮食小鼠中补充LCZ可能对乳酸菌科相关肠道微生物的光谱有更积极的影响。
低铁组和对照组的粪便微生物组成也存在显著差异(R=0.56,P<0.001),其中低铁组的拟杆菌门丰度较高。拟杆菌门是人类肠道中最大的革兰氏阴性菌门,是维持宿主结肠环境健康和复杂稳态的主要角色。肠道失调可改变宿主的免疫和代谢。进一步分析拟杆菌门内的响应成员,低铁饲粮小鼠肠道拟杆菌的相对丰度显著增加,补充LCZ可抑制这种变化。黄素和L-组氨酸生物合成途径均与肠拟杆菌呈显著负相关。组氨酸能促进铁的吸收,对贫血有治疗作用。
在益生菌组(对照饮食和低铁饮食)中唯一检测到Parabacteroides distasonis。其与黄素生物合成途径呈正相关;与促炎因子IL-18呈显著负相关。许多研究报道,补充Parabacteroides distasonis可以缓解代谢功能障碍,降低炎症标志物的水平。Parabacteroides goldsteinii在LI组中富集,甚至在第8周成为流行物种。黄素生物合成途径与其呈显著负相关。虽然之前的研究表明这一物种有抗肥胖效果,但这可能是低铁饮食的一个新指标。
膳食缺铁可能导致低度炎症;因此,测定了三组患者的血清细胞因子谱。IL-18是唯一测到的组间有显著差异的细胞因子,它是一种在多种细胞中表达的促炎细胞因子,是一些疾病的生物标志物,包括心血管疾病、代谢性荨麻疹综合征、哮喘、皮炎、鼻炎和其他过敏性疾病。IL-18可诱导Th1细胞产生其他细胞因子,促进T细胞增殖。但没有显示其他细胞因子如IFN-gamma和IL-13水平的显著差异,这可能与低铁饮食的摄入时间和炎症的严重程度有关。为了研究Th1细胞和其他细胞的分化情况,也可以更全面地了解低铁饮食对宿主免疫的影响。IL-18与Parabacteroides distasonis之间存在显著的负相关。第8周时,CT组血清IL-18水平明显低于LI组,益生菌干预可显著降低血清IL-18水平,从而缓解低铁饮食引起的低级炎症。LCZ的免疫调节作用已在动物模型中得到证实,免疫调节功能及其在临床中的潜在应用值得进一步研究。本研究结果可为低铁饮食消费者开发新型功能性产品提供参考。
本研究从粪便微生物群、免疫因子谱、血清铁状态等方面综合研究了低铁饲粮和补充LCZ对小鼠的影响,但存在一定的局限性。样本量小可能导致统计能力不足,无法发现益生菌治疗引起的微小差异;为了进一步说明益生菌干预的效果,在干预研究中还需要考虑更多的因素,如治疗时间、益生菌治疗形式、剂量等。本研究没有纳入雌性小鼠,在营养研究中使用单性实验动物可能会导致不完整的结论。
结论
低铁饮食显著改变了粪便微生物群的结构,降低了肠道细菌多样性。补充益生菌一定程度上保护了低铁饮食介导的肠道菌群的改变和受影响的代谢途径(即L-组氨酸和黄素的生物合成途径)。补充LCZ可显著降低促炎因子,血清IL-18水平并对血清TIBC有调节作用。
免责声明:本文仅代表作者个人观点,与中国益生菌网无关。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
版权声明
1.本站部分转载的文章非原创,其版权和文责属于原作者。2.本网所有转载文章、链接及图片系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,对可以提供充分证据的侵权信息,bio149将在确认后12小时内删除。3.欢迎用户投递原创文章至86371366@qq.com,经审核后发布到首页,其版权和文责属于投递者。







