内蒙古农大刘文俊团队最新力作:植物乳杆菌PS-8对紫花苜蓿青贮过程中化学成分、结构和功能性微生物群的影响
时间:2022-02-09 来源:微生态 作者:bio149发布 浏览次数:2491导读
畜牧业的快速发展导致动物饲料的需求不断增加。紫花苜蓿具有较高的蛋白质和矿物质含量及良好的适口性,是优质饲料。然而相较于其他牧草,紫花苜蓿(Medicago sativa)饲料有一个潜在的问题,其高缓冲能力和低含量水溶性碳水化合物(WSC)使pH难以降低,而有利于腐败细菌的生长,进而导致存储问题。此外,南方的高湿度和多雨气候进一步加剧了贮藏问题,缩短了青贮保质期。因此为了克服这个问题,需要制定能够有效抑制发酵过程中腐败和不良微生物生长、改善营养保存、延长青贮饲料货架期的策略。
添加外源微生物以提高青贮饲料的生产,不仅能够最大限度地保存营养物质,而且延长了产品的保质期,通过重建宏基因组组装基因组(MAG)和生长速率InDex(GRiD),在青贮发酵第0、7、14、28天监测紫花苜蓿质量和数量的变化(PS-8接种剂量为1×105 CFU/g鲜重;每袋50 kg;每个时间点10袋)。结果表明,外源发酵菌PS-8(L. plantarum)在接种第7天时成为最具优势的菌株,可能在整个发酵过程中发挥了高度活跃的作用。青贮饲料的pH明显下降,同时产酸微生物PS-8的生长抑制了霉菌(4.18 vs 1.42 CFU/g)和大肠菌群(4.95 vs 0.66 MPN/g)的生长,中性洗涤纤维(NDF)含量显著下降(干物质含量为41.6% vs 37.6%)。此外,在整个发酵过程中,编码微生物碳水化合物活性酶(CAZymes)的基因丰度和多样性显著增加,特别是负责降解淀粉、阿拉伯-木聚糖和纤维素的基因。我们的研究结果显示,PS-8在发酵早期和中期快速持续复制,促进有益乳酸菌的生长,抑制不良微生物,最终提高青贮质量。
论文ID
原名:Changes in chemical composition, structural and functional microbiome during Alfalfa (Medicago sativa) ensilage with Lactobacillus plantarum PS-8
译名:植物乳杆菌PS-8对紫花苜蓿青贮过程中化学成分、结构和功能性微生物群的影响
期刊:Animal Nutrition
IF:6.383
发表时间:2022.1.24
通讯作者:刘文俊
通讯作者单位:内蒙古农业大学乳品生物技术与工程教育部重点实验室
DOI号:10.1016/j.aninu.2021.12.004
实验设计
将新鲜紫花苜蓿带到青贮地点,在阳光下枯萎至约50%的水分含量,把饲料切碎后喷洒PS-8(1×105CFU/g),随机装入真空密封聚乙烯塑料袋中(每袋约50 kg;共40袋),包装的青贮样品保存在室温(20-25℃),且28天没有任何气体调节措施,在第0、7、14和28天采集新鲜(标记为d0)和封闭的材料进行微生物和化学分析。除第0天外,每个时间点共打开10个包装袋取样,采集浓缩样本进行细菌宏基因组学和化学成分分析。青贮样品(每个25 g)加入225 mL去离子水中涡旋混合30 min,使用pH仪进行pH测定,在55℃的强制空气烘箱中干燥72 h后测定干物质(DM)含量,再研磨进行粗蛋白(CP)、可溶性蛋白(SP)、酸性洗涤纤维(ADF)、中性洗涤纤维(NDF)、WSC和氨氮(NH3-N)分析,乳酸、乙酸、γ-氨基丁酸和苯基乳酸的检测采用超高性能液相色谱-电喷雾电离-四极飞行时间质谱测定。每个样品25 g用无菌PBS溶液稀释10次,4℃下浸泡24 h,然后用无菌纱布过滤,滤液离心,收集细菌泥浆的沉淀物,使用E.Z.N.A.土壤DNA试剂盒进行样品DNA提取,并用1%琼脂糖凝胶电泳和分光光度分析检测提取的DNA的质量,制备片段的DNA文库(约400 bp长),这些样品在Illumina HiSeq Xten仪器上进行鸟枪法宏基因组测序,正向和反向均产生配对端reads(151 bp)。
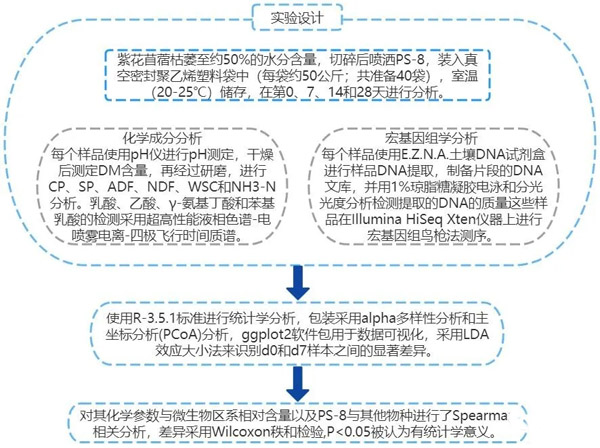
图1 实验设计图
前言
内生青贮饲料是一种传统的基于微生物厌氧发酵的饲料保存方法,主要采用乳酸菌(LAB)。在此过程中,绿色原料中WSC发酵成如乳酸和醋酸的有机酸,导致pH下降,抑制不良微生物生长。虽然在青贮发酵过程中约有10%的营养损失,但在发酵中产生的有机酸和有机螯合物矿物质更容易被反刍动物吸收。最常见的LAB是同型发酵,如植物乳杆菌和豌豆球菌,纯乳酸发酵是理想的,因为它具有极高的理论DM回收率和乳酸的高效生产,乳酸的释放导致pH比其他类型酸下降地更快。发酵是一个微生物驱动的过程,青贮发酵的质量高度依赖于青贮过程中涉及微生物的活动和类型,加速其他微生物对WSC的利用速度,并产生有机酸的有益微生物对青贮发酵过程贡献很大,相比之下,一些不受欢迎的微生物可能会导致青贮饲料的腐败。本研究选择接种同型发酵实验室菌株PS-8对紫花苜蓿青贮发酵的影响,在之前的研究中,该菌株已被证明有利于提高青贮发酵和牛奶生产的质量和数量,PS-8的贡献可以通过监测复杂附生植物微生物群落的演替与青贮饲料化学成分的变化来评价。
研究假设添加外源LAB可以通过调节青贮微生物群来改善紫花苜蓿的青贮过程,虽然之前的一些工作研究了微生物青贮发酵剂在青贮过程的应用,但很少有通过全基因组宏基因组学方法对微生物动态进行深入研究,有助于揭示青贮微生物群和PS-8在不同发酵阶段的功能潜力和活力。因此本研究利用宏基因组分析,研究了PS-8作为青贮发酵剂菌株在促进青贮发酵中的贡献,采用单样本宏基因组组装方法,对其微生物群落结构和功能进行了动态评估,重点研究了紫花苜蓿青贮发酵不同阶段的GRiD和碳水化合物代谢的变化,同时对青贮发酵过程中的一些化学参数进行了监测。
实验结果
1 紫花苜蓿青贮发酵过程中的化学变化
监测发酵青贮饲料化学方面(如化学成分、微生物群和pH)的变化可以为青贮饲料发酵的进展和质量提供指示。在青贮发酵过程中,DM含量无明显变化,SP含量随发酵时间的增加而增加,虽然含量变化不显著,但有明显的增加趋势。NH3-N含量在前7天显著增加(P<0.05),在第7~14天之间达到稳定阶段,然后在第14~28天之间显著下降(P<0.05)。NDF在第7天时显著下降(P<0.05),此后无显著变化,WSC总体上呈下降趋势(表1)。
乳酸含量随发酵时间的增加而显著增加,并在第28天时达到最大值(P<0.05),乙酸含量呈上升趋势,在第14天和28天时均有显著增加(P<0.05),γ-氨基丁酸含量在第14天开始显著增加(P<0.05),苯基乳酸含量在第14~28天显著增加(P<0.05)。发酵过程中有机酸含量持续积累,霉菌和大肠菌群的数量被显著抑制,并降低到检测限以下的水平(表1;表S2),紫花苜蓿青贮饲料的pH值从第7天开始显著下降(P<0.05)。
表1 紫花苜蓿青贮过程中理化参数、霉菌和大肠菌群计数的变化。
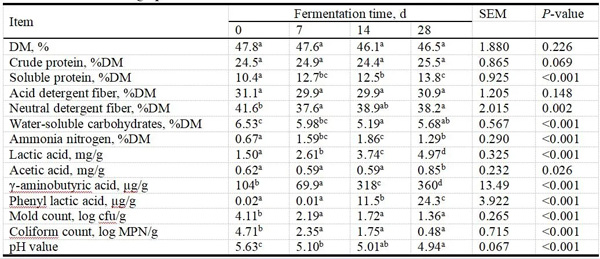
(SEM=平均标准误差;MPN=最可能数;a-d不同时间点相同参数的数据采用Kruskal-Wallis检验进行统计学比较;用不同的字母表示有显著性差异(P<0.05)。
2 发酵过程中青贮微生物群的动态变化
为了解微生物对青贮发酵的贡献,采用鸟枪法宏基因组测序技术分析了PS-8青贮微生物群在发酵前后和发酵第7、14、28天的动态变化,测序数据量见表S1。发酵过程分为2个阶段,即微生物变化剧烈的(L. plantarum和Pediococcus pentosaceus)增殖阶段(第0~7天)和微生物变化不明显的稳定阶段(第7~28天)。
青贮微生物群的alpha多样性在早期显著增加(P<0.001),随后在稳定期略有波动(图2A)。基于Bray-Curtis距离进行的PCoA也表明,初始青贮微生物群(d0)在结构上与后来的时间点不同(图2B)。紫花苜蓿青贮微生物群在稳定期(第7~28天)的Bray-Curtis距离明显低于第0天的基线水平(图2C)。
在种水平上,所有样本中均鉴定出7种主要细菌类别(图2D),发酵前后的微生物区系组成存在明显差异,在第0天,青贮微生物群主要为Weissella cibaria (82.4%)和Pantoea agglomerans(3.22%),以紫花苜蓿附生种序列为主,第7天后,青贮微生物群组成保持稳定,主要以L. plantarum(31.4%)、W. cibaria(31.2%)和P. pentosaceus(11.4%)3种序列为主。发酵开始后,W. cibaria的相对丰度显著降低,而L. plantarum和P. pentosaceus的相对丰度显著增加,分别在发酵第28天和第7天达到最高水平。
然后采用LDA、Kruskal-Wallis检验和Wilcoxon秩和检验来确定d0和d7样品之间的微生物组成的差异。LDA结果显示,W. cibaria和Pantoea ananatis在第0天富集(P<0.05),而L. plantarum、P. pentosaceus、L. sakei、L. pentosus、L. coryniformi、Lactococcus garvieae、Pediococcus lolii、Weissella paramesenteroides、 L. curvatus、L. brevis和L. farciminis 在第7天富集(P<0.05;图2E),这些差异丰富的类群是导致发酵前后微生物群结构差异的主要原因。
青贮化学参数与物种水平微生物组成之间存在频繁的相关性(图2F)。发酵开始后,一些种(包括L. plantarum、W. paramesenteroides、L. brevis、L. curvatus和L. farciminis)与化学参数(包括4种有机酸,特别是乳酸、SP和NH3-N)呈正相关,这些物种与pH、霉菌和大肠菌群的数量、NDF和WSC呈负相关。
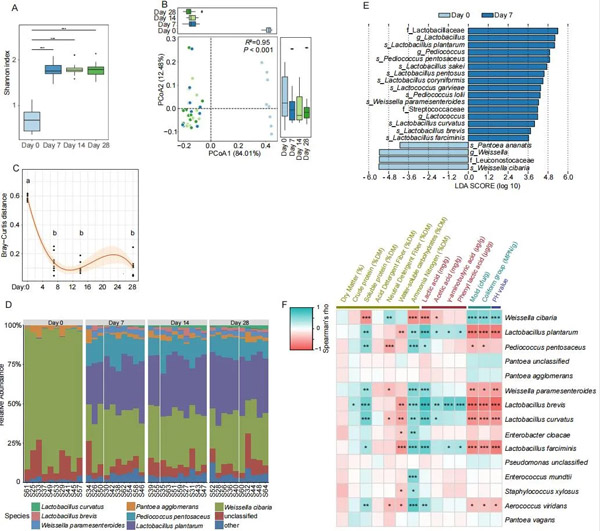
图2 不同时间点紫花苜蓿青贮微生物群落结构与理化指标的关系(A)箱线图显示Shannon多样性指数。(B)主坐标分析(PCoA;Bray-Curtis距离)。(C)Bray-Curtis距离。用不同的字母表示有显著性差异(P<0.05),利用局部估计的散点图平滑(黄土)对数据进行曲线拟合,粉红色区域对应于曲线的95%置信区间。(D)堆叠柱状图显示了已鉴定物种的相对丰度。(E)线性判别分析(LDA)显示在d0和d7之间存在差异丰富的类群。(F)15个优势种和14个生物/化学参数的Spearman相关热图。MPN=最有可能的数字。颜色尺度代表了Spearman的rho,显示了相关性的强度。(* P < 0.05, ** P < 0.01, ***P < 0.001)(原文图1)。
3 青贮微生物群的种类水平及PS-8含量的变化
青贮微生物区系的变化表明,植物乳杆菌的发酵水平显著升高,并在发酵过程中成为优势种。为了明确PS-8作为外源发酵剂在发酵过程中的作用,我们计算了不同时间点PS-8 reads在全基因组中的相对丰度(图3A;表S1),其比例从第0~7天显著增加,从第7~28天保持稳定,范围为0.5%~29%。通过使用MetaBAT2的宏基因组箱从支架中获得1100个原始箱,然后去除高污染的不完整箱,保留162个高质量MAG(>80%完整性,<5%污染;表S3),这些MAG被鉴定为22个具有代表性的种级基因组箱(SGB),并通过RPKM获得丰度。利用这些高质量的MAG构建了一个系统发育树,并考虑到其分类分配和测序深度(图3B;表S3),根据与PS-8参考基因组99%的截止水平,162个MAG中有10个被鉴定为PS-8(图3C),计算每个时间点的PS-8在全基因组中的比例和GRiD值(代表PS-8的复制率),PS-8在第7和第14天具有更高的网格值,代表相对于总体微生物丰度的活力,然后在第28天急剧下降(图3D;表S3)。此外还计算了青贮发酵环境中PS-8与其他已鉴定物种之间的相关性(图3E),PS-8的相对丰度与其他乳酸菌呈显著正相关(r>0.6,P<0.001),而PS-8与W. cibaria、Enterobacter agglomerans、Erwinia iniecta、Serratia marcescens和Pseudomonas sp.之间呈显著负相关(r > 0.3, P < 0.05)。
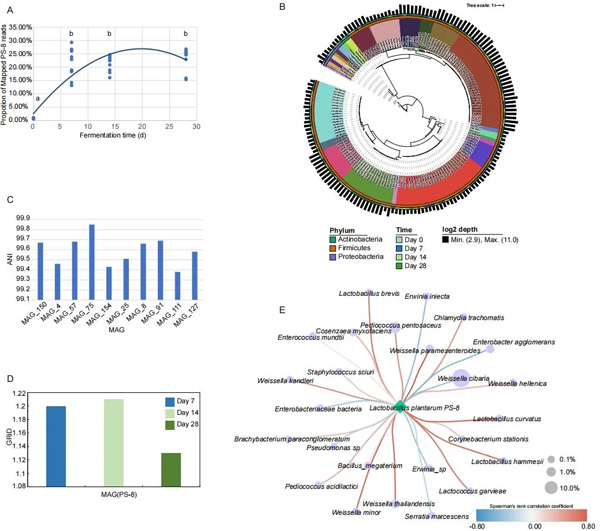
图3 紫花苜蓿青贮微生物菌群中的植物乳杆菌PS-8。(A)不同发酵时间点PS-8 reads的比例。用不同的字母表示有显著性差异(P<0.05)。(B)基于宏基因组组装基因组(MAG)构建的系统发育树。从最外层到内层分别代表测序深度、时间点、细菌门和细菌种类。(C)青贮微生物菌群中植物乳杆菌PS-8与10个植物乳杆菌MAG的平均核苷酸同源性(ANI)。(D)直方图显示了PS-8在第7天、第14天和第28天的生长速率InDex(GRiD)。(E)植物乳杆菌PS-8与其他种的Spearman相关性分析。每个物种用一个圆表示,圆的大小代表该物种的相对丰度。颜色尺度代表了Spearman的rho,显示了相关性的强度(原文图2)。
4 微生物多糖降解基因的预测
青贮发酵的质量很大程度上取决于多糖的降解效率,由此对青贮微生物群中的微生物CAZyme基因进行了预测,基于CAZymes计算的Shannon指数在青贮发酵开始后的d0和时间点之间有显著差异(d7、14、28;P<0.05;图4A)。第7天至第28天Shannon指数无统计学差异,PCoA分析支持了这样的结果(图4B),PCoA评分图上的右侧聚类只包含d7的样本,而左侧聚类只包含d7~28的样本。
对碳水化合物利用具有遗传能力的类群被认为是微生物发酵过程中的重要因素。因此我们对宏基因组中的CAZymes进行了预测(表S4),预测了22种代表性MAG的5种碳水化合物(淀粉、果胶、阿拉伯木聚糖、果聚糖、纤维素)的基因组降解能力(图4C),许多Lactobacillus和Weissella,包括 L. curvatus、L. brevis、L. plantarum、W. cibaria、W. hellenica和W. kandleri携带较高的CAZyme基因,具有降解淀粉、阿拉伯木聚糖和纤维素的巨大潜力,一些细菌类群携带可降解果胶和果聚糖的基因,包括相对较高水平的糖苷水解酶(GH)、糖苷转移酶(GT)和碳水化合物酯酶(CE)(图4D)。
在微生物发酵过程中,饲料中的多糖分解为单糖,进一步酶解转化为丙酮酸,然后底物进入有氧和厌氧糖酵解途径,产生5种发酵产物,即甲酸、乳酸、醋酸、丁酸和琥珀酸(图4E)。因此我们查阅了植物发酵相关文献(底物利用和特定发酵最终产物的生产),并利用本研究获得的MAG信息进行了分析,做出14个属22个代表性MAG宏基因组中5种植物碳水化合物的降解途径预测示意图(图4E)。另外,计算物种丰度发现Lactobacillus和Weissella在发酵后发生了显著变化(图S1)。
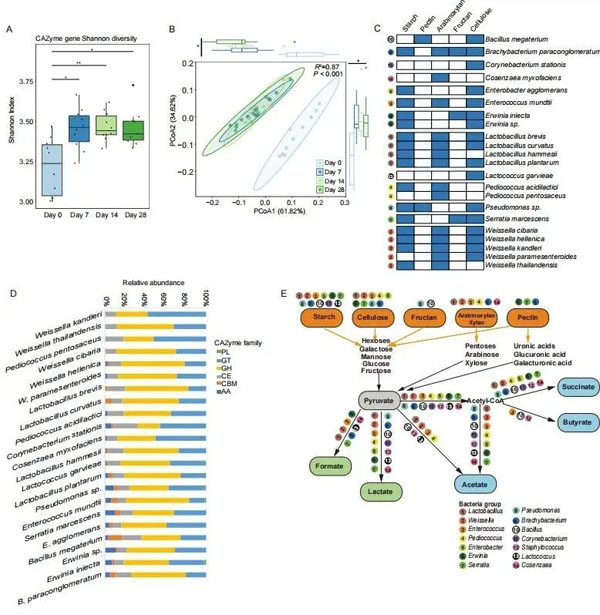
图4 预测了微生物宏基因组中的多糖降解基因和途径。(A)不同时间点编码CAZymes预测基因的Shannon多样性指数。(B)不同时间点CAZyme基因的主坐标分析。组间显示显著性(R2=0.87,P<0.001)。(C)22个具有代表性的宏基因组组装基因组(MAG)在多糖降解过程中的宏基因组潜力,反映在拥有编码碳水化合物活性酶(CAZymes)的基因上。充满蓝色和白色的盒子分别代表某些MAG中特定基因的存在或缺失。(D)CAZyme编码基因在22个代表性MAG中的分布。(E)利用代谢研究的信息,从22个具有代表性的MAG(在属水平上显示)预测的植物碳水化合物降解和代谢的简化发酵途径示意图(原文图3)。
讨论
青贮发酵的质量在很大程度上取决于饲料中微生物的数量和类型及可溶性碳水化合物的可用性,接种外源发酵剂LAB有助于提高青贮原料中有益微生物与有害微生物的比例,促进发酵过程。虽然之前研究证明了应用外源细菌添加剂加速青贮过程的有益作用,但很少有研究监测发酵过程中细菌宏基因组和外源发酵菌的动态。基于MAG重建的宏基因组研究不仅提供了物种水平不同的微生物宏基因组(如多糖代谢相关的基因/通路)在不同发酵阶段的功能潜力信息,还提供了一种跟踪启动器的可行性及其潜在贡献过程通过使用目标指数如网格,计算从组装细菌的基因丰度的变化基因组。
紫花苜蓿发酵饲料的质量直接反映在青贮饲料的化学成分和微生物群的组成上。微生物通过植物多糖降解导致一系列化学反应来影响饲料的特性,通常发酵紫花苜蓿青贮,特别是添加LAB发酵剂的青贮,会含有大量的有机酸(特别是乳酸),这是由于青贮原料中的微生物利用碳水化合物,大大降低了青贮过程中的pH。结果表明,几种优势种(L. plantarum、W. paramesenteroides、L. brevis,L. curvatus和L. farciminis)与4种有机酸(特别是乳酸)呈正相关。高酸度可以帮助抑制霉菌和大肠菌群的不良生长,潜在地增加青贮饲料的稳定性和保质期,霉菌和大肠菌群总是会导致营养物质的损失和增加毒素污染的机会。Larissa等人发现,饲料中的有机酸不仅有助于长期储存,而且提高了奶牛对饲料的摄入量,从而提高了生长性能,随着有害微生物数量的减少,微生物的代谢需求减少,饲料能量和营养物质对宿主动物的可用性也会增加,从而导致生长速率和饲料效率的提高。WSC含量与细菌利用碳水化合物作为底物生长和随后合成乳酸有关,由于发酵后乳酸杆菌(L. plantarum、L. brevis、L. curvatus和L. farciminis)含量增加,WSC含量显著降低,可能加速了乳酸的产生。据报道乳酸发酵导致的发酵青贮饲料的DM损失通常不会超过5%,而本研究在整个发酵过程中观察到DM含量稳定,证实其主要是乳酸发酵。青贮饲料中的NH3-N是青贮过程中蛋白质水解的一个指标,通常是由植物酶和微生物活性引起的,结果表明多种微生物与NH3-N含量呈正相关,这可能与紫花苜蓿中蛋白质含量丰富,NH3-N积累率较高有关。随着青贮发酵的进行,蛋白质的氨化在发酵开始时迅速,在发酵后期下降,pH持续下降,直到发酵后期微生物活性和NH3-N释放受到抑制,与麦克加维等人的研究结果一致,部分物种(包括L. plantarum、P. pentosaceus、W. paramesenteroides、L. brevis、L. curvatus和L. farciminis)与SP水平呈显著正相关,可提高紫花苜蓿青贮蛋白的消化率,防止可溶性氨进一步产生,这些物种还与饲料发酵过程中ADF和NDF含量的降低有关,而纤维的降解可以有效地提高饲料的适口性和消化率。
对发酵没有影响的死亡细胞的细菌DNA也可以被测序,为了克服这一问题,我们的研究在组装单个菌株基因组的基础上计算了菌株GRiD,这反映了外源性添加剂PS-8的复制,并允许跟踪其变化及其在发酵中的作用。我们的研究结果显示,PS-8在发酵的第一周生长迅速,这可能是由于它相对于其他附生细菌的竞争优势,此前的一项研究发现,含有<10%附生LAB种群的接种剂能够影响青贮发酵的效率,无论紫花苜蓿在发酵前是否进行消毒,外源接种乳酸菌最终导致该属在发酵青贮饲料中占优势,本研究中PS-8在发酵过程中GRiD值的增加表明PS-8具有活性,特别是在早期阶段。随着pH值的持续下降,PS-8的生长受到限制,甚至在第28天出现下降,但在青贮微生物群中仍占显著比例。Guo等人报道了紫花苜蓿青贮发酵后的相对丰度也有类似的变化趋势,PS-8对青贮微生物群的一个可能的有益机制可能是它促进各种产酸LAB的生长,许多LAB可以产生细菌素,PS-8是一种具有高抗菌活性的益生菌,促进有益细菌生长而抑制有害细菌生长。良好的发酵剂通常具有杀菌和/或抑菌活性,最终使其成为青贮发酵过程中的普遍菌株,高效发酵能减少不良微生物也可以提高DM。Dong等人发现,在莎草中添加多年生黑麦草,Lactobacillus和Weissella等有利微生物将在整个采集时间内占据主导地位,同样,Wang等人报道了当紫花苜蓿与辣木叶混合60天时,乳酸菌的丰度最高。He等人发现紫花苜蓿青贮发酵质量差的青贮过程中与乳酸菌相对丰度较低有关。前期研究发现,参与青贮饲料乳酸发酵的细菌主要属于Lactobacillus、Pediococcus和Weissella,并且我们的研究发现PS-8在整个发酵过程中占主导地位,这种现象可能是由于PS-8对 Enterobacterium和P. agglomerans等不利微生物的生长具有很强的抑制活性,这些微生物在青贮发酵过程中可以产生酒精,抑制这些微生物反过来可以促进发酵,同时发酵开始促进有益菌Lactobacillus和Weissella的生长,这些属的增加可导致乳酸产量增加,pH值降低,从而提高青贮质量。
紫花苜蓿WSC含量低,缓冲能力高,纤维含量高,难以维持高稳定的青贮品质,其大部分多糖不能被动物直接利用,添加WSC和外源微生物发酵剂会降低缓冲能力,促进不可消化的植物多糖发酵成营养物质,以支持细菌的生长。微生物CAZyme基因编码的酶具有将大分子碳水化合物降解为小分子的能力,从而提高了饲料的适口性和消化率。我们的研究观察到多种CAZyme编码基因以及携带与淀粉、阿拉伯木聚糖和纤维素降解相关的MAG基因增加,GH编码基因水平最高,这些酶可以有效地代谢植物多糖,如淀粉和淀粉相关底物。此外它们还具有良好的降解纤维素和半纤维素(阿拉伯木聚糖)的能力,这需要β-1,4-阿拉伯木聚糖酶和低聚酶的协同作用,研究表明52和106个细菌MAG分别携带内作用-β-1,4-阿拉伯木聚糖酶和β-木聚糖酶,表明纤维素和阿拉伯木聚糖具有良好的宏基因组分解潜力。之前的一项研究试图通过测量最终产物通量或从参考代谢途径的纯培养或混合培养中推断微生物青贮发酵过程中产生的代谢产物,本研究根据以往对饲料发酵的代谢研究,从组装的单个细菌基因组中推断出优势细菌对饲料碳水化合物的降解和代谢。
结论
本研究表明,在青贮过程中添加植物乳杆菌PS-8可以通过加快酸化速率调节青贮微生物群,从而提高青贮品质,特别是促进LAB的生长,抑制霉菌和大肠菌群等不良微生物。此外,PS-8在发酵早期和中期快速持续复制,在青贮过程中,添加PS-8的青贮饲料NDF水平显著降低。这些结果表明,PS-8在改善青贮品质、营养保存和可能延长青贮货架期方面具有积极的作用。本研究为外源LAB接种物改善青贮的机理提供了新的信息,有助于提高商品青贮的生产效率和质量。
免责声明:本文仅代表作者个人观点,与中国益生菌网无关。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
版权声明
1.本站部分转载的文章非原创,其版权和文责属于原作者。2.本网所有转载文章、链接及图片系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,对可以提供充分证据的侵权信息,bio149将在确认后12小时内删除。3.欢迎用户投递原创文章至86371366@qq.com,经审核后发布到首页,其版权和文责属于投递者。







