乳果糖可调节肠道菌群结构并减轻结肠炎相关肿瘤的发生
时间:2022-03-03 来源:微生态 作者:微生态 浏览次数:2381乳果糖是一种半乳糖-果糖双糖,由乳糖加热或异构化制成。被认为可以调节肠道菌群,因此有望在治疗炎症性肠病中发挥作用。本研究中,我们研究了乳果糖对结直肠癌小鼠模型胃肠道炎症及相关肿瘤发生的治疗作用,以及对肠道菌群组成的影响。采用偶氮甲烷(AOM)/葡聚糖硫酸钠(DSS)模型。以2%乳果糖喂养14周。取4个时间点的粪便样本进行菌群宏基因组分析。注射AOM后21周进行病理分析。AOM/DSS增加了巨噬细胞计数、炎症细胞因子表达、结直肠肿瘤发生和肠道菌群组成的失衡,证明了病原体丰度的增加(如大肠杆菌和梭状芽胞杆菌)。乳果糖能显著抑制炎症,改善炎症和肿瘤发生。乳果糖处理后肠道菌群的组成也得到了恢复,降低了病原菌丰度,增加了Muribaculum和毛螺菌科的丰度。同时,与克罗恩病相关的通路在乳果糖治疗后被下调。研究结果表明,乳果糖可以恢复肠道菌群的结构和组成,减轻炎症,并抑制炎症性肿瘤的发生。
论文ID
原名:Lactulose Modulates the Structure of Gut Microbiota and Alleviates Colitis-Associated Tumorigenesis
译名:乳果糖可调节肠道菌群结构并减轻结肠炎相关肿瘤的发生
期刊:Nutrients
IF:5.717
发表时间:2022.2.3
通讯作者:Lin-Hai Kurahara
通讯作者单位:日本香川大学医学部心血管生理学系
DOI号:10.3390/nu14030649
实验设计
本实验采用6周龄雌性C57BL/6NCrSlc小鼠,分为对照组、AOM和DSS组(AOM/DSS)、AOM/DSS加乳糖治疗组(AOM/DSS+乳糖) (每组n=8)。对照组腹腔注射生理盐水,喂食正常食物和饮用水,为期21周。AOM/DSS组第0天腹腔注射AOM,一周后,DSS给药。AOM/DSS+乳果糖组中,在最后一次DSS给药1周后开始喂食含2%乳果糖的食物14周。分别于AOM给药时间(T0)、给药后6周(T1)、12周(T2)、21周(T3)采集粪便样本进行评分,并每组选取5只小鼠的粪便进行宏基因组分析。整块切除盲肠、肛门和脾脏之间的肠道。测量盲肠和肛门之间的肠道长度。然后纵向切开肠道,计算息肉数量。制作组织切片,进行组织病理学评价。结肠部分提取RNA进行实时PCR,挤取盲肠内容物以T3时间点定量测定乙酸、丙酸、正丁酸、异丁酸、正戊酸和异戊酸进行短链脂肪酸的定量研究。
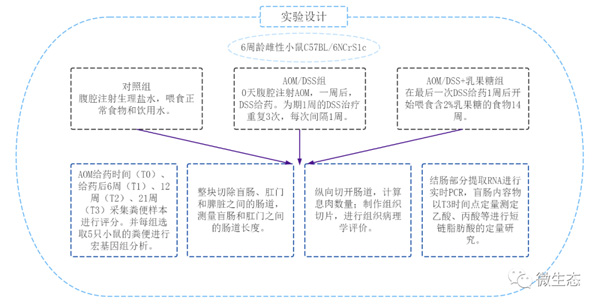
图1 实验设计图
前言
近年来,以溃疡性结肠炎和克罗恩病为主的炎症性肠病(IBD)患者数量呈上升趋势。IBD的特点是胃肠道炎症、体重减轻和直肠出血。IBD主要是由于CD4+辅助T细胞和白细胞介素-17分泌过多而引起的免疫系统功能紊乱。巨噬细胞在IBD的发病机制中也起着重要作用。它们主要分为经典激活型和交替激活型两种。经典活化巨噬细胞(CD68+)的特征是分泌促炎细胞因子IL-1β、IL-6、IL-12和TNF-α。与癌变相关的过程,如凋亡、增殖和血管生成都是由炎症介质(如TNF-α)执行的。IBD常与炎症相关的结直肠癌相关。IBD相关的结直肠癌约占CRC年死亡率的2%,但在IBD患者中,每年死亡的人数占10-15%。IBD相关CRC患者的发病年龄也小于散发性CRC患者,5年生存率仅为50%。因此,确定除手术以外的临床方法来缓解IBD和CAC是至关重要的。菌群干预(益生菌、益生元、抗生素、菌群移植、基因操纵等)已在IBD治疗中得到实际应用。并对CAC有一定的预防和改善作用。
乳果糖是一种由半乳糖和果糖组成的双糖,是牛奶加热过程中的产物。乳果糖常被用作食品添加剂,目前还用于治疗便秘、肝性脑病和慢性肾病。它在人体中不被消化酶代谢,可直接到达胃肠道的炎症区域。因此,乳果糖用于治疗胃肠道疾病已被研究,并被证明对IBD具有保护作用。用乳果糖的半乳糖寡糖衍生物治疗也可以改善由偶氮甲烷(AOM)和葡聚糖硫酸钠(DSS)诱导的炎症性肿瘤小鼠模型的癌症进展和恢复菌群多样性。肠道菌群对低聚半乳糖的代谢可能与其治疗作用有关。体外实验表明,乳果糖被35种肠道菌代谢,并通过激活双歧杆菌和乳杆菌促进短链脂肪酸的产生。乳果糖处理的个体肠道菌群多样性发生了变化,产生乳酸源益生菌的双歧杆菌丰度增加,致病菌如拟杆菌和梭状芽胞杆菌丰度减少。因此,推测乳果糖可恢复肠道菌群结构,从而减轻炎症,抑制炎症相关的肿瘤发生。
本研究通过使用AOM和DSS联合给药产生的相关炎症肿瘤小鼠模型来解决这一假设,研究了乳果糖对肿瘤发展、炎症事件(包括纤维化-炎症信号转导)以及肠道菌群结构和组成的影响,以获得乳果糖治疗作用的机制。
实验结果
1 乳果糖抑制AOM/DSS模型相关病理的发展
AOM/DSS无乳糖治疗组小鼠会出现稀便、腹泻、年疝(图2B、C)。在T3时间点,粪便一致性评分(图2B)、异常及大出血评分(图2C)、肿瘤数量(图2D)、脾脏重量明显增加(与对照组相比)(图2E)。脾肿大表明免疫反应增强。14周的2%乳果糖治疗(约3 g/kg BW/天)显著抑制了肿瘤数量和脾脏重量的增加(图2B-E)。
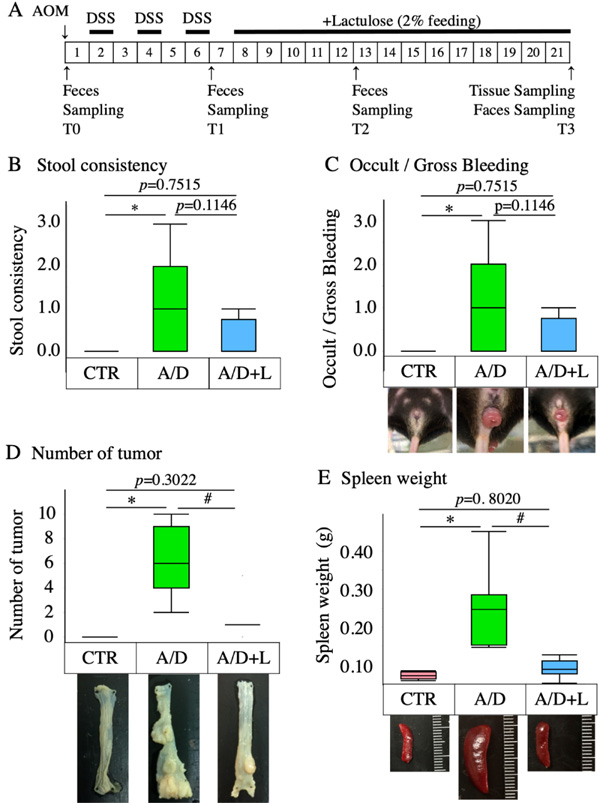
图2 乳果糖对AOS/DSS模型相关病理发展的抑制作用。 (A)显示了生成AOM/DSS模型(A/D)和随后用乳果糖(A/D+L)处理的实验方案。第0天小鼠腹腔注射偶氮甲烷(AOM)(12mg/kg体重); 1周后,给予小鼠2%的葡聚糖硫酸钠(DSS)治疗,持续1周。1周DSS治疗重复3次,间隔1周。最后一次DSS治疗一周后开始乳果糖治疗。小鼠被喂食含有乳糖的食物14周。乳果糖剂量约为2g/kg体重/天。AOM/DSS无乳果糖治疗组(A/D)以正常饲料代替含乳果糖饲料。对照组(CTR)不给予AOM、DSS和乳果糖。分别于注射AOM后第0天(T0)、第6周(T1)、第12周(T2)、第21周(T3)采集粪便样本。所有评估均在AOM注射后21周进行。B-E:大便一致性评分(B)、异常/大出血评分(C)、脾脏重量(D)、肿瘤数量(E)总结。数据以箱线图表示(n=8)。*代表与CTR相比p<0.05,#代表与AOM/DSS相比p<0.05。(原文图1)
2 乳果糖治疗减轻了AOM/DSS模型中的炎症事件
组织病理学评估显示AOM/DSS对非肿瘤区隐窝和粘膜层造成损伤(图3A)。肿瘤切片HE染色显示结肠直肠癌相应的组织病理学特征(图3A,肿瘤)。AOM/DSS显著增加非肿瘤区炎症评分(图3B)。乳果糖治疗可改善这些损伤并抑制炎症(图3A和B)。AOM/DSS诱导了非肿瘤区纤维化(图3C),并显著增加非肿瘤区纤维化评分(图3D)。乳果糖治疗可减轻纤维化;但对纤维化评分无显著影响(p=0.22349)(图3C和D)。在AOM/DSS模型中,非肿瘤区和肿瘤区CD68阳性细胞的黏膜和黏膜下浸润增加(图3E和F)。乳果糖显著抑制了CD68阳性细胞在黏膜和黏膜下区域的浸润(图3E和F)。
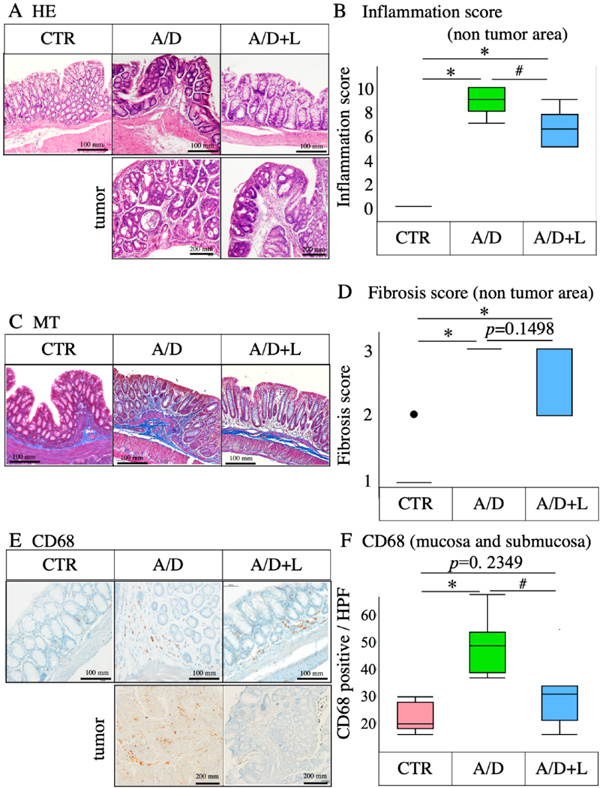
图3 AOM/DSS模型中乳果糖对炎症事件的抑制作用。(A)肿瘤和非肿瘤区域HE染色的代表性显微照片。(B)对照组(CTR)、AOM/DSS (A/D)和AOM/DSS+乳糖(A/D+L)组非肿瘤区炎症评分(n=8)。(C) MT染色代表性显微照片。(D)所示实验组非肿瘤区纤维化评分总结。(E)非肿瘤区和肿瘤区CD68免疫组化检测的代表性显微照片。(F)在指定的实验组中,每高倍视野(HPF:0.196mm2)在非肿瘤区域粘膜层和粘膜下层CD68阳性细胞的数量。数据以箱线图表示(n=8)。*代表与CTR相比p<0.05,#代表与AOM/DSS相比p<0.05。(原文图2)
3 乳果糖抑制了AOM/DSS模型中炎症细胞因子的上调
AOM/DSS显著提高了TNF-α、IL-6和TGF-β1转录水平的表达,但未提高INF-γ的表达(图4)。乳果糖可显著抑制TNF-α和IL-6的上调,而对TGF-β1和INF-γ水平无显著影响。
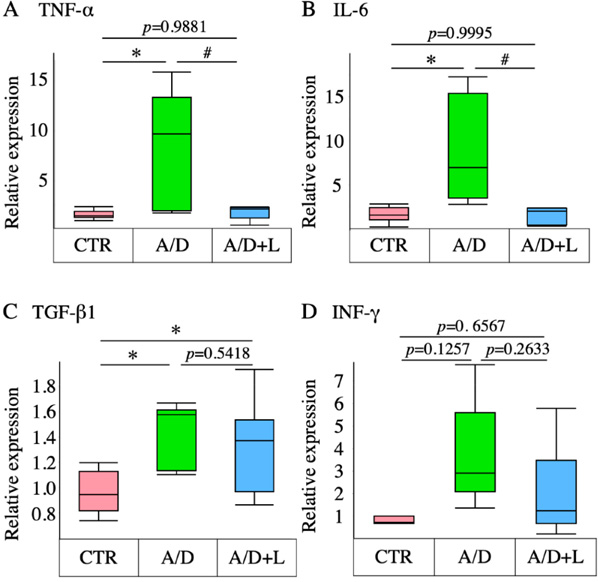
图4 AOM/DSS模型中乳果糖对炎症细胞因子转录水平表达的影响。肿瘤坏死因子α(TNF-α)(A)、白介素6(IL-6)(B)、转化生长因子β1(TGF-β1)(C)、干扰素γ(INF-γ)(D)在对照组(CTR)、AOM/DSS(A/D)和AOM/DSS+乳糖(A/D+L)组的转录水平表达。数据以箱线图表示(n=8)。*代表与CTR相比p<0.05,#代表与AOM/DSS相比p<0.05。(原文图3)
4 AOM/DSS对盲肠粪便中短链脂肪酸水平没有任何影响
短链脂肪酸是肠道菌群的产物,据报道,短链脂肪酸不仅作为宿主的能量来源,而且具有生物学效应,包括肿瘤抑制效应(1,2)。以盲肠内容物中乙酸、丙酸、正丁酸、异丁酸、正戊酸和异戊酸的浓度作为肠道菌群生产短链脂肪酸的指标(图5)。AOM/DSS和乳果糖对盲肠粪便中这些酸的浓度没有显著影响。

图5 AOM/DSS模型中短链脂肪酸水平分析。对照组(CTR)、AOM/DSS组(A/D)和AOM/DSS+乳糖组(A/D+L)盲肠内容物中乙酸(A)、丙酸(B)、正丁酸(C)、异丁酸(D)、正戊酸(E)和异戊酸(F)的含量。图(D,F)中的圆圈分别是异常值。数据以箱线图表示(n=8)。(原文图4)
5 AOM/DSS模型下乳果糖处理后粪便菌群组成的恢复
计算不同样品之间的Bray-Curtis距离,并根据NMDS分析和ANOSIM检验结果,确定三组粪便细菌组成的差异(图6)。最初,在T0时间点各组间的菌群组成无显著差异(p=0.138,图6A,E)。AOM/DSS处理(T1)后,对照组的样本聚集在远离其他组的地方(p<0.05)(图6B)。对照组与AOM/DSS+乳糖组之间的距离大于对照组与AOM/DSS组之间的距离(图6B,E)。经乳果糖(T2)治疗5周后,对照组和AOM/DSS+乳果糖组比T1时更接近(图6C),而对照组和AOM/DSS+乳果糖组与对照组和AOM/DSS组相比有显著性差异(图6E)。乳果糖(T3)处理14周后,AOM/DSS组样品与对照组样品显著分离(p<0.05),而对照组与AOM/DSS+乳果糖组样品之间无显著差异(p=0.205)(图6D,6E)。
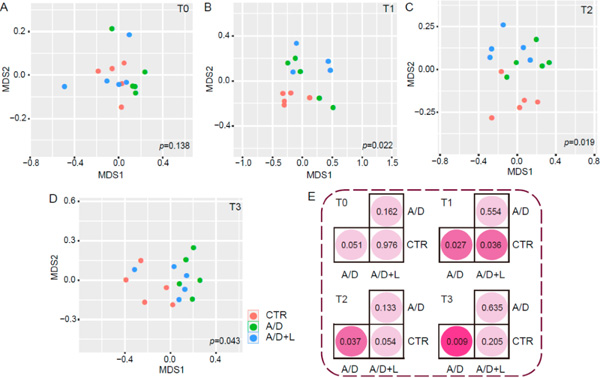
图6 乳果糖对AOM/DSS模型中粪便菌群组成的影响。 对照(CTR)、AOM/DSS (A/D)和AOM/DSS+乳果糖(A/D+L)组(n=5)在T0 (A)、T1 (B)、T2 (C)、T3 (D)时间点按MDS1和MDS2的特征值进行降维后的散点图。基于Bray-Curtis距离的NMDS分析显示了每个样本的特征值。通过ANOSIM检验计算三组之间(a-d)和两组之间的p值(E)。(原文图5)
6 乳果糖改变AOM/DSS处理后的肠道细菌组成
由于AOM/DSS和乳果糖处理显著影响了肠道菌群组成,因此我们探讨了处理对肠道菌群组成的影响。采用Wilcoxon检验计算对照组和AOM/DSS处理组(AOM/DSS和AOM/DSS+乳果糖组)在T1时的微生物组成差异,其中有5个属(在图7A中用*标记)和6个种(在图7B中用*标记)显示出显著的变化(p<0.05)。AOM/DSS处理组(与对照组相比)肠道条件致病菌大肠杆菌和梭状芽胞杆菌的相对丰度显著增加,而Muribaculum和毛螺菌科(毛螺菌科被认为是短链脂肪酸生产者)的相对丰度降低。AOM/DSS模型肠道中细菌的相对丰度在T2时恢复,因为毛螺菌科的丰度显著增加,而大肠杆菌和梭状芽孢杆菌的相对丰度降低(图7A)。从T1到T2恢复的属(图7A)或种(图7B)中,乳果糖处理(AOM/DSS+乳果糖)比正常饮食(AOM/DSS)更有利于AOM/DSS诱导的肠道菌群紊乱的恢复。此外,根据T2和T3之间细菌的差异来评价长期给予乳果糖对肠道菌群的影响(图7C)。3个属中的4个种的丰度发生了显著变化,其中肠乳杆菌、鼠乳杆菌和Bacteroides caecimuris的丰度显著增加,而Mucispirillum schaedleri的丰度显著降低。
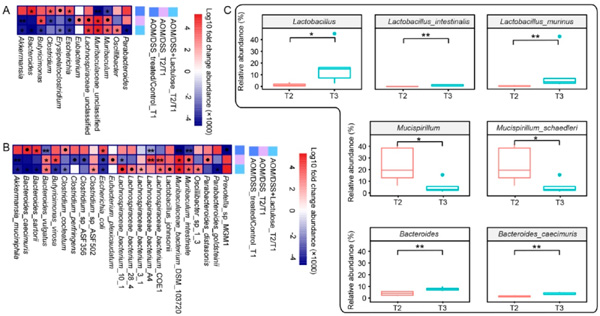
图7 AOM/DSS模型中乳果糖对粪便微生物组成的影响。(A,B)微生物群落丰度的折变热图(A属,B种)表明:对照与AOM/DSS在T1, AOM/DSS和AOM/DSS+乳糖在T1与T2。采用减法计算微生物组成的差异,采用Wilcoxon检验计算显著性。折叠变化的log10(×1000)的缩放值如图所示。●代表0.05<p<0.06,*代表p<0.05,**代表p<0.01(n=5)。(C) AOM/DSS+乳糖组T2和T3指示属和种的相对丰度。*代表p<0.05,**代表p<0.01 (n=5)。(原文图6)
7 乳果糖改变了AOM/DSS模型中肠道菌群的功能特性
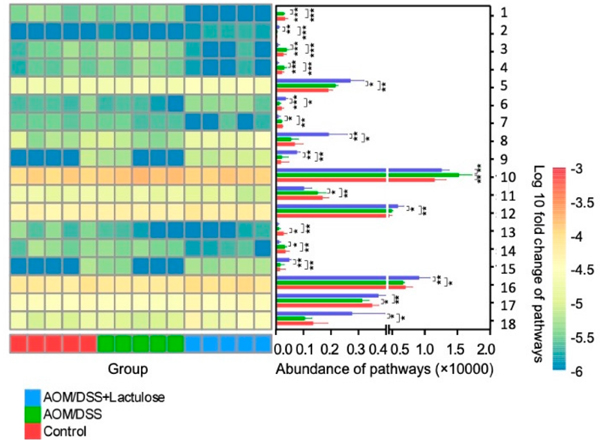
通过分析功能通路,了解不同时间点肠道菌群的功能变化。对40条与AOM/DSS处理组(AOM/DSS和AOM/DSS+乳果糖组)显著差异的通路进行分析,发现淀粉降解III通路(表S1,No.16)和血红素生物合成通路(表S1,No.2)显著上调,而氨基酸代谢通路,如L-蛋氨酸生物合成III途径(表S1,No.27)和L-苏氨酸生物合成通路(表S1, No.40)均被显著下调。标准差列于表S1。淀粉降解和氨基酸代谢与IBD等胃肠道疾病有关,而血红素生物合成已被证明有助于细菌致病,促进炎症反应,并使IBD患者的预后恶化。关于乳果糖的影响(图7),血红素生物合成(图8,Nos.3和4)和L-组氨酸降解(图8,No.13)被下调,而N-乙酰葡糖氨和N-乙酰甘露糖胺超途径和N-乙酰神经胺酸(图8,No.5)和L-1,2-丙二醇降解途径(图8,No.8)在乳果糖摄入后显著上调(p<0.05与对照组和AOM/DSS组进行比较,图8,表S2-4)。据报道,编码1,2-丙二醇代谢途径中介物的基因在克罗恩病中上调,并显示与肠道病原体的生长有关。上述结果表明,AOM/DSS显著影响了肠道菌群的组成和功能通路,而乳果糖改善了肠道菌群的相对丰度和功能通路,这一现象可能与AOM/DSS引起的症状缓解有关。
1 肽聚糖生物合成V;β-内酰胺抗药性
2 乙二醇代谢和降解途径
3 甘氨酸途径合成血红素
4 尿卟啉原-III途径合成血红素
5 N-乙酰葡糖氨,N-乙酰甘露糖胺,N-乙酰神经胺酸降解途径
6 硫酸盐降解途径
7 L-赖氨酸生物合成
8 L-1,2-丙二醇降解
9 光呼吸
10 黄素生物合成I(细菌和植物)
11 鸟苷核苷酸降解(植物)途径
12 N-乙酰神经胺酸降解途径
13 L-组氨酸降解II
14 多胺生物合成II途径
15 甲醛同化I(丝氨酸途径)
16 嘧啶脱氧核糖核苷酸的从头生物合成III
17 L-鸟氨酸从头合成
18 Myo-,chiro-,和scillo-肌醇降解
图8 T2时三组间代谢途径的差异。 对照组、AOM/DSS、AOM/DSS+乳果糖三组间差异显著的前18条通路(p<0.01)。热图显示了每个样本中路径的丰度(每百万拷贝数),柱状图显示了每组中各路径的平均丰度。对照组与AOM/DSS、对照组与AOM/DSS+乳果糖、AOM/DSS与AOM/DSS+乳果糖组的显著性采用t检验进行分析。*代表p<0.05,**代表p<0.01,***代表p<0.001(n=5)。详情见补充表S1-S4。(原文图7)
讨论
基于益生元和渗透性泻药的特性,乳果糖已被用作泻药治疗便秘超过50年。本研究首次证明,在结肠炎相关的肿瘤小鼠模型中,乳果糖能恢复受损的胃肠道细菌的组成和功能。在AOM/DSS小鼠模型中,乳果糖可减少炎症和肿瘤数量,并改善巨噬细胞计数和促炎细胞因子的表达。
与A/D组相比,乳果糖治疗并没有改变粪便的一致性(p=0.1146)。本研究中使用的乳果糖剂量(在小鼠体内为2.4~2.6g/kg BW/天)不会引起腹泻或泻药作用,部分原因是该剂量(根据“人体等效剂量”,相当于人体0.2g/kg BW/天)低于用于治疗成人便秘的剂量(0.43-0.65g/kg)。此外,溃疡性结肠炎(UC)患者便秘症状的发展是公认的。在这种情况下,乳果糖可能对缓解便秘有额外的有益效果。
β多样性分析表明,短期摄入乳糖可使AOM/DSS处理后肠道菌群组成恢复平衡,而长期摄入乳糖更有利于肠道菌群组成的健康变化。大量研究表明,乳果糖增加了有益肠道细菌(双歧杆菌和乳杆菌)的数量,提高了有利代谢产物的水平,减少了有害肠道细菌(梭状芽孢杆菌)的数量,并降低了粪便pH值。本研究中,乳果糖显著降低了大肠杆菌和产气荚膜梭菌的丰度,增加了Muribaculaceae的丰度。在小鼠模型中大肠杆菌通过产生大肠杆菌素,一种基因毒性分子,来促进CAC。也有报道称产气荚膜梭菌是一种可加速CAC进展的病原体。Muribaculaceae和产气荚膜梭菌是主要的粘蛋白单糖觅食者,它们在肠道中占据相同的生态位。随着乳果糖摄入后N-乙酰葡糖氨降解途径的升级,推测随后更丰富的Muribaculaceae导致了更多的N-乙酰葡糖氨的消耗,并阻碍了产气荚膜梭菌在肠道中的定植。乳果糖还逆转了AOM/DSS处理对毛螺菌科丰度的抑制。毛螺菌科是厌氧、发酵和化学有机营养的,其中一些表现出很强的水解活性,并利用淀粉、菊粉和阿拉伯木聚糖。毛螺菌科与促进肠道病原体定植、短链脂肪酸的产生和胆汁酸代谢有关。短链脂肪酸也有抑制肿瘤的作用。然而,本研究中没有发现盲肠短链脂肪酸在对照组、AOM/DSS和AOM/DSS+乳糖组之间存在差异。盲肠粪便短链脂肪酸似乎没有促进乳果糖抑制肿瘤的作用。乳果糖也能促进乳酸菌和双歧杆菌的生长,尤其促进结肠中的乳杆菌的生长。同时,乳果糖增加了肠乳杆菌和鼠乳杆菌的丰度。相比之下,对小鼠模型中的沙门氏菌结肠炎有保护作用的Mucispirillum schaedleri的丰度被乳果糖抑制。
碳水化合物代谢在细菌功能中起着重要作用。IBD患者淀粉降解和氨基酸代谢途径受到显著影响。因此,膳食纤维,如抗性淀粉,被认为是一种有前途的治疗IBD的方法。本研究揭示了AOM/DSS中淀粉降解和氨基酸代谢途径的相似变化。据报道,血红素生物合成可诱导小鼠肠道生态失调,加重结肠炎,并促进腺瘤的发展。乳果糖下调血红素生物合成途径。这可能是乳果糖治疗AOM/DSS的作用之一。编码1,2-丙二醇合成中介物的基因在克罗恩病患者中表达上调。乳果糖上调了L-1,2-丙二醇降解途径。此外,摄入乳果糖后N-乙酰神经胺酸降解升级这一事实可能表明,细胞表面聚糖表达的改变在癌症中起着关键作用(如抗凋亡和增强增殖)。这些效应可能与AOM/DSS的治疗效果有关。乳果糖具有预防和治疗IBD相关肿瘤发生的潜力。然而,这种乳果糖介导的抑制机制尚不清楚。确定这些机制将是我们下一阶段调查的主题。
AOM/DSS小鼠处于促炎状态,表现为肠道缩短、脾肿大、粪便和肛门状况受损,炎症纤维化评分增加,巨噬细胞浸润,炎症细胞因子TNF-α、IL-6、TGF-β1表达增加。即使在非肿瘤区域,巨噬细胞计数增加,促炎状态增强。这些结果与以前的报告中的结果一致。据报道,TNF-α在AOM/DSS处理的小鼠中上调,而其受体TNF-Rp55在结肠和粘膜层的白细胞上表达。TNF-α与TNF-Rp55结合导致NF-κB和COX-2上调。IL-6已被报道参与炎症和纤维化,并调节免疫系统和激活癌症相关信号转导通路,如NF-κB和STAT3。乳果糖减轻了这些促炎状态。乳果糖的这种抗炎作用和抗肿瘤作用此前已有报道。本研究首次将乳果糖对AOM/DSS病理的影响与其对肠道菌群及其代谢途径的影响联系起来。
结论
综上所述,乳果糖可能是一种有潜力的治疗IBD及其相关肿瘤的药物。它对炎症和肿瘤发生的治疗作用至少部分归因于菌群结构和组成的恢复,这与健康受试者中与菌群相关的功能和代谢途径的恢复有关。
免责声明:本文仅代表作者个人观点,与中国益生菌网无关。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
版权声明
1.本站部分转载的文章非原创,其版权和文责属于原作者。2.本网所有转载文章、链接及图片系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,对可以提供充分证据的侵权信息,bio149将在确认后12小时内删除。3.欢迎用户投递原创文章至86371366@qq.com,经审核后发布到首页,其版权和文责属于投递者。







