导读
铅暴露是一个全球性的公共卫生安全问题,会严重干扰大脑发育,并在生命早期对神经系统造成损害。益生菌和肠道微生物因其在减轻铅毒性方面的关键作用而被强调。然而,它们发挥作用的潜在机制还有待充分探索。本研究设计了一个两阶段的实验,使用益生菌发酵乳杆菌HNU312(Lf312),以揭示益生菌如何在生命早期减轻铅对大脑的毒性。首先,研究了Lf312对铅的体外耐受性和吸附性。其次,对菌株的体内吸附能力进行了测定和验证。鸟枪法宏基因组测序显示铅暴露诱导的肠道微生物组失衡和功能障碍。相比之下,摄入Lf312显著调节了微生物组的结构,增加了有益细菌和短链脂肪酸(SCFAs)产生细菌的丰度,并上调了功能相关的代谢途径,如抗氧化剂。值得注意的是,Lf312通过增加肠道中SCFAs的水平来增强血脑屏障的完整性,缓解大脑中的炎症,并最终改善由铅暴露引起的小鼠的焦虑和抑郁行为。随后,进一步证实了Lf312的作用机制,强调Lf312是通过离子吸附和微生物-肠-脑轴调控等综合策略发挥作用的。综上所述,本研究阐明了肠道菌群减轻铅在大脑中的毒性作用的机制,并为儿童大规模铅中毒导致的脑损伤提供了预防措施和干预措施。
论文ID
原名:Lactobacillus fermentum HNU312 alleviated oxidative damage and behavioural abnormalities during brain development in early life induced by chronic lead exposure
译名:发酵乳杆菌HNU312可以缓解由慢性铅暴露引起的早期大脑发育过程中的氧化损伤和行为异常
期刊:Ecotoxicology and Environmental Safety
IF:7.129
发表时间:2023.1
通讯作者:张家超,孙志宏
通讯作者单位:海南大学;内蒙古农业大学乳品生物技术与工程教育部重点实验室
DOI号:10.1016/j.ecoenv.2023.114543
实验设计
首先进行Lf312对铅吸附和耐受性的体外实验,Lf312的铅耐受性由最小抑菌浓度(MIC)法测定(图1A),实验组将杀菌的醋酸铅溶液加入MRS琼脂培养基中并接种菌液,无铅MRS琼脂培养基作为对照,37℃孵育48 h后观察Lf312的生长情况;Lf312孵育18 h,离心后重新悬浮在无菌超纯水中,重复两次,将杀菌的醋酸铅溶液与细菌混合,对照组采用无铅超纯水,pH值调至5.0,37℃摇床中孵育1 h后离心,采用火焰原子吸收光谱法测定上清液中残铅含量,得到Lf312对铅的吸附率。细胞小球用于场发射扫描电子显微镜(FESEM)和透射电子显微镜(TEM)测试(图1B)。之后进行Lf312缓解铅毒性的体外实验,将小鼠随机分为Con组(无铅饮用水,n=12)、Pb组(含铅饮用水,(CH3COO)2Pb·3H2O,1g Pb2+/L,n=12)和Pro组(含铅饮用水,(CH3COO)2Pb·3H2O,1g Pb2+/L,8Log10 CFU/d Lf312,n=12)(图1C)。在实验结束前一周进行行为测试。在实验的第0、2、5和8周收集小鼠粪便,测定其铅含量。在第8周时,收集脑组织以测定其铅含量和免疫和氧化指标,并对粪便进行鸟枪宏基因组测序和短链脂肪酸(SCFAs)测定。

图1 实验设计图。测定了Lf312对铅的耐受性(A)和吸附性(B)。(C)体内实验。小鼠随机分为3组:Con组(无铅饮用水,盐水每日灌胃);Pb组(含铅饮用水,盐水每日灌胃);Pro组(含铅饮用水,每日灌胃Lf312)。
前言
铅(Pb)是毒性最大的重金属之一,在人体中没有任何必要的生理作用。近年来,随着工业化和城市化的不断发展,全球铅的生产和消费大幅增长,导致土壤和水体中的铅含量不断上升。铅暴露影响细胞膜,还可以通过各种机制促进活性氧和活性氮的产生,导致体内氧化应激。还会影响肾脏、肝脏、造血系统和骨骼系统,并对神经系统构成严重风险。一些研究表明,在神经发育的关键时期,接触铅会对儿童的神经系统产生重大影响。目前,螯合疗法是治疗重金属中毒的主要方法,但螯合药物的保存方法、副作用和安全性存在一定的缺陷。因此,开发新的饮食治疗策略对于预防铅暴露引起的脑组织和神经损伤至关重要。乳酸菌(LAB)价格低廉,作为生物吸附剂性能良好。它们不仅具有清除铅的能力,而且大多数对人体健康都有益。近年来,LAB作为生物吸附剂对铅的吸附机理的探索得到了较好的发展。LAB为革兰氏阳性菌,其细胞壁主要由肽聚糖组成,细胞壁外的糖蛋白以及黏液层具有吸附重金属离子的功能。在生长过程中,LAB在细胞外分泌的胞外多糖或带电基团也可与Pb2+在离子交换、络合、表面沉淀和静电相互作用等过程中相互作用。LAB还可以通过将铅离子结合到其表面并排泄来减去铅离子,从而减少小鼠体内的铅积累以分离金属离子。然而,许多研究都局限于描述铅离子消减的机制或通过LAB的细胞自我功能来降低机体的伤害,肠道微生物组通过对益生菌的反应来减轻铅毒性的机制尚未得到充分的探索。为了解决这一问题,本研究对海南发酵食品中分离的一株发酵乳杆菌HNU312(Lf312)进行了两阶段实验。第一阶段,考察了Lf312对铅的体外吸附和耐受性。在第二阶段,使用C57BL/6J雄性小鼠,通过鸟枪宏基因组技术研究Lf312对小鼠慢性铅中毒的预防作用,包括如何通过肠道微生物组减轻小鼠的大脑氧化损伤和炎症以及行为异常。这项研究阐明了肠道微生物群减轻铅对大脑的毒性作用的机制,并为铅引起的儿童脑损伤提供了预防措施。
结果
具有高铅耐受性的菌株可以在宿主肠道中稳定定植生长,并在肠道中遇到铅时发挥作用。其对铅的吸附性能也决定了菌株能否在宿主肠道吸收Pb2+之前先结合并清除体内的铅。如图S2所示,Lf312对铅的MIC至少为5g Pb2+/L,而150 mg Pb2+/L时的吸附率达到27.8%。FESEM和TEM观察表明,铅处理后细菌有聚集现象。另外,部分细菌的结构被破坏,在细菌表面观察到一些颗粒,能谱(EDS)中存在铅峰(图2A和E),而未接触铅的细菌结构完整且分布均匀,在EDS中没有发现铅的波峰(图2B和F)。在透射电镜中,铅处理后的细菌周围和内部有深色沉淀。在对照组中没有观察到这种现象,尽管不能证明沉淀物被铅吸附(图2C和D)。
图2 Lf312吸附铅的FESEM和TEM观察。Lf312吸附铅(A)和未暴露于铅(B)后细菌的扫描电镜状态。在透射电镜下,Lf312吸附铅(C)和未暴露于铅(D)后的细胞形态。能谱仪分别在扫描电镜(SEM)和透射电镜(TEM)中扫描了吸附铅后的细菌(E)和未暴露于铅的细菌(F)。
2 、Lf312可减轻慢性铅暴露引起的小鼠异常行为和脑损伤
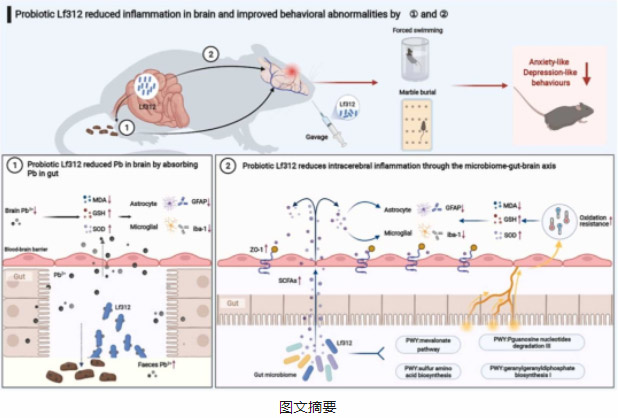
在大理石掩埋试验中,铅暴露小鼠掩埋的大理石数量明显增加,而Pro组与Con组之间没有显著差异(图3A)。类似地,Pb组小鼠在强迫游泳测试中表现出更高的静止倾向。相比之下,Pro组的静止减少,这表明暴露于慢性铅的小鼠的焦虑样行为和抑郁样行为增加,而Lf312缓解了焦虑和抑郁(图3B)。但是,我们仍然可以观察到治疗组小鼠的休息时间明显最高,尽管在本研究的强迫游泳测试中没有显著差异。这可能是因为饮用铅水的方法可能需要更长的治疗时间,以使抑郁行为对年轻小鼠更显著。随着铅暴露时间的延长,Pb组和Pro组粪便铅含量迅速升高,且显著高于Con组。从第2周开始,Pro组的粪便铅含量高于Pb组,直到第5周才差异显著。第8周时,Pro组与Pb组的粪便铅含量差异显著。相比之下,Pb组粪便铅含量在第2周后没有明显变化(图3C)。在第8周,脑铅含量呈现相反的趋势。Pb组的铅含量明显高于Pro组(图3D),说明Lf312能显著促进粪便中铅离子的排泄,减少铅在脑组织中的积累。长期接触铅会导致氧化性脑损伤。与对照组相比,Pb组小鼠脑组织中MDA含量明显升高(图3E),GSH含量和SOD活性明显降低(图3F和G)。Pro组小鼠脑组织氧化损伤明显改善,MDA、GSH和SOD水平接近Con组。在CA3海马区,Pb组GFAP和iba-1荧光强度高于Con组和Pro组(图4A)。阳性面积比的量化支持了这一结论(图4B)。相比之下,Pro组和对照组小鼠海马区荧光强度保持了相对类似的高、低强度趋势。因此,Pb组小鼠大脑的炎症反应高于Con和Pro组。与Pb组相比,Con组和Pro组的ZO-1在纹状体CPU部位的表达水平显著高于Pb组,这表明Lf312的干预增强了血脑屏障(图4A和B)。
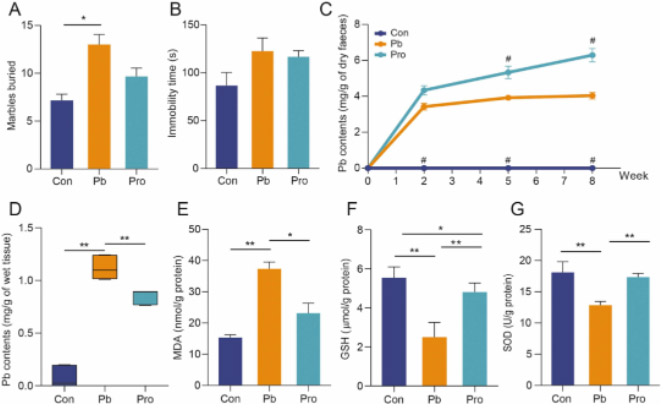
图3 Lf312对慢性铅暴露引起的小鼠行为异常、粪便和脑铅水平以及氧化性脑损伤的影响。(A)大理石掩埋试验。埋弹珠的数量与焦虑行为成正比。(B)强迫游泳测试。静止不动的持续时间与抑郁行为成正比。(C)各组小鼠粪便铅含量。#表示与Pb组差异显著(#P<0.05)。(D)各组小鼠脑内铅含量。(E)小鼠脑组织中MDA含量。(F)小鼠脑组织中GSH的含量。(G)小鼠脑组织中SOD的活性。(Wilcoxon秩和检验,*P<0.05,**P<0.01,误差条:平均值±SEM)。
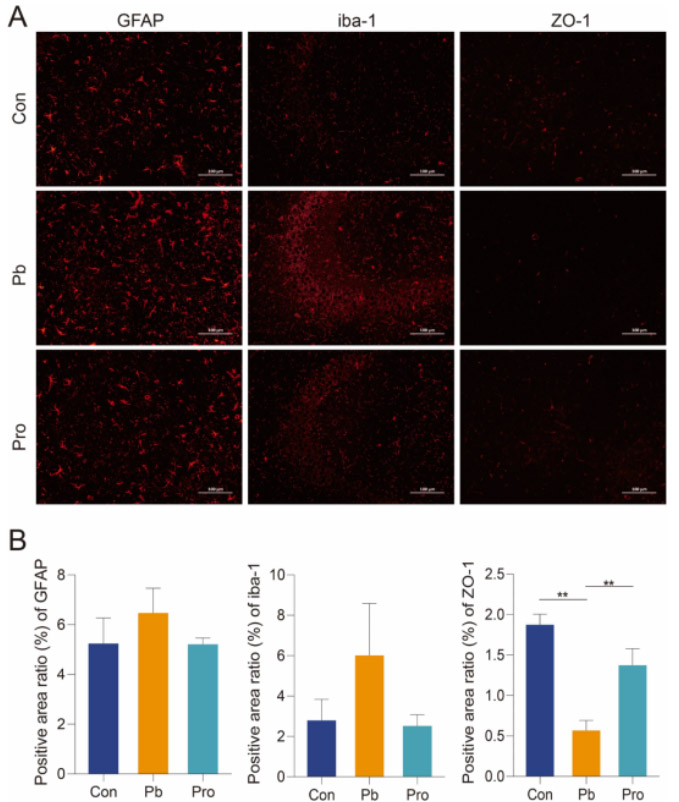
图4 Lf312对铅暴露所致小鼠大脑炎症和血脑屏障的影响。(A)海马CA3区GFAP和iba-1免疫荧光(红色);纹状体中的ZO-1免疫荧光(红色)。(B) GFAP、iba-1和ZO-1的阳性面积比。(方差分析检验,*P<0.05,**P<0.01,***P<0.001,误差条:平均值±SEM)。
3 、Lf312恢复了铅暴露引起的肠道微生物组的失衡和功能障碍
分析了微生物组的结构,以阐明肠道微生物组在铅暴露环境中发挥作用的具体机制。Lf312的干预恢复了由慢性铅暴露引起的小鼠肠道微生物群α多样性的下降(图5A)。基于Bray-Curtis距离的PCoA如图5B所示,三组间形成了不同的聚类趋势(P<0.05)。进一步量化Pb组和Pro组相对于Con组的Bray-Curtis距离,我们发现Pro组和Con组之间的距离明显低于Pb组(图5C),这表明Lf312能够将菌群纠正到更接近健康水平,尽管三组间菌群存在差异。为了进一步研究肠道微生物组对铅暴露环境的具体反应,对三组小鼠进行了肠道微生物组差异菌株的筛选(图5D)。慢性铅暴露导致Bacteroides faecichinchillae、Faecalibaculum rodentium、Lachnospiraceae bacterium 284和部分乳酸菌(如Lactobacillus intestinalis、Lactobacillus johnsonii、Lactobacillus murinus和Lactobacillus reuteri)的丰度显著下降。与Pb组相比,Pro组中Bacteroides uniformis、Bacteroides caecimuris、Lactobacillus fermentum、L. reuteri、Parabacteroides distasonis、Parabacteroides goldsteinii等物种的丰度显著增加。在这些不同的物种中,我们观察到Lf312的干预引起了某些SCFAs产生细菌(Bacteroides uniformis、P. distasonis、P. goldsteinii和L. reuteri)的反应,这些细菌在Pro组中获得了显著更高的丰度。(图5E)。由于我们已经确定慢性铅暴露对小鼠肠道微生物组有显著影响,为了进一步阐明不同微生物组对宿主产生的影响,我们根据以下条件筛选了关键的差异代谢通路:Con组与Pb组之间存在显著差异,Pro组与Pb组之间存在显著差异,而Con组与Pro组之间没有显著的物种差异。慢性铅暴露环境下,特定微生物代谢通路的变化表现为香叶基香叶基焦磷酸生物合成超通路I、甲羟戊酸通路I、鸟苷核苷酸降解超通路III和硫氨基酸生物合成超通路的显著下调。相比之下,ADP-L-甘油-D-甘露庚糖生物合成、TCA循环VII(乙酸盐生产者)和钼蝶呤生物合成等途径显著富集。有趣的是,这些通路的丰度被Lf312修正并恢复到正常水平(图5G)。
图5 Lf312对小鼠肠道微生物群及代谢产物的影响。(A)小鼠肠道菌群α多样性(Simpson指数和Shannon指数)分析。(B) PCoA显示基于Bray-curtis距离的微生物组成差异。每个点代表一个样品的菌群组成。(C) Pb组和Pro组与Con组的Bray-Curtis距离的定量比较。(D)三组之间的差异物种的比较。颜色的深度代表该物种的相对丰度(紫色表示少量,红色表示大量)。(E)三组SCFAs产生菌的相对丰度(B. uniformis、L. reuteri、P. distasonis和P. goldsteinii)。(F)三组粪便中SCFAs含量的比较。(G)关键差异代谢途径的分析。Log2FC值大于0,说明Pro组比Pb组富集度更高。(Wilcoxon秩和检验,*P<0.05,**P<0.01,***P<0.001,误差条:平均值±SEM)。
4 、肠道微生物组通过促进SCFAs的释放来缓解铅暴露引起的脑损伤
慢性铅暴露引起的肠道微生物组的结构和功能改变也影响了宿主肠道代谢物的变化。铅暴露导致粪便中SCFAs(丙酸、异丁酸、丁酸、异戊酸和戊酸)水平显著降低,而Pro组和Con组之间没有显著差异(图5I)。值得注意的是,Pro组的乙酸含量显著高于其他两组。此外,Pro组的乙酸、异丁酸和丁酸含量均显著高于Pb组。如前所述,Lf312的摄入导致小鼠粪便中铅排泄增加,这直接导致小鼠大脑中铅富集减少(负相关)。更关键的是,Lf312促进了L. reuteri、B. uniformis、P. distasonis和P. goldsteinii在小鼠肠道中的富集。有趣的是,虽然Lf312与L. reuteri的相关性不强,但后者与脑铅含量和MDA含量呈负相关,与SOD活性及SCFAs和GSH含量呈正相关,并影响差异表达的代谢通路的上调或下调。这些对Lf312反应的关键微生物产生了SCFAs(乙酸、丙酸、丁酸、戊酸、异丁酸和异戊酸)。SCFAs不仅能提高小鼠脑组织中MDA、SOD和GSH的水平,还能缓解小鼠脑组织炎症指标,维持血脑屏障(ZO-1)的通透性。此外,SCFAs还上调或下调关键的差异代谢途径。反过来,这些差异表达的代谢途径进一步影响了大脑中氧化指标的水平。因此,Lf312通过物理外部铅排泄缓解小鼠的氧化性脑损伤和脑内炎症,同时伴随SCFAs和代谢途径,最终减轻小鼠的焦虑样行为和抑郁样行为(图6)。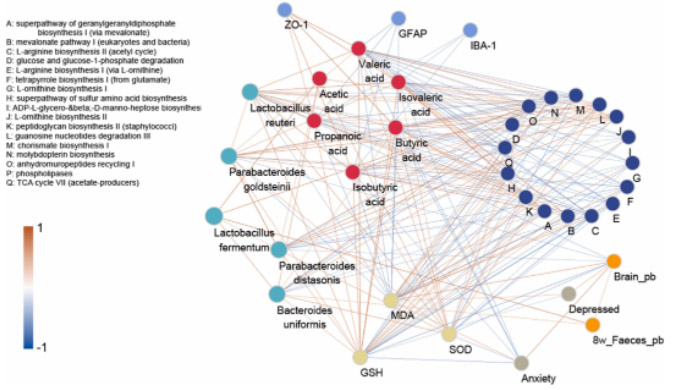
图6 基于各指标的相关网络。基于Spearman等级相关系数,利用基本差异菌群、SCFAs、氧化指数、炎症指标、行为指标、粪便铅水平(第8周)、脑铅含量和关键差异代谢途径构建相关网络。Lf312可通过增加铅外排来减少宿主脑铅积累。此外,Lf312和L. reuteri促进了B. uniformis、P. distasonis和P. goldsteinii的丰度升高。相比之下,这些微生物有助于增加SCFAs水平,改善氧化损伤和炎症,并调节关键的功能性代谢途径。最终,小鼠的焦虑样行为和抑郁样行为减弱。选择小于-0.4或大于0.4的R值。边缘宽度和颜色(红色为正相关,蓝色为负相关)与相关强度成正比。
讨论
慢性铅暴露会导致神经退行性病变和精神障碍,表现为认知改变、记忆障碍、抑郁和焦虑障碍等行为变化。慢性铅暴露导致小鼠焦虑和抑郁行为增加,而摄入Lf312对小鼠的这些行为有明显的拮抗作用。铅可能通过多种机制引发脑损伤,主要是通过降低脑细胞的抗氧化能力。大脑易受氧化应激的影响,因为吸入的氧气中约有20-30%被大脑消耗。抗氧化系统的关键指标包括MDA、GSH和SOD。众所周知,铅引起的氧化干扰会导致氧化损伤,进而导致血脑屏障的破坏。血脑屏障是铅中毒的主要靶点,当血脑屏障受损时,中枢神经系统(CNS)更容易受到外源物质的干扰和损伤,引发神经炎症。中枢神经系统中的胶质细胞(星形胶质细胞和小胶质细胞)执行各种重要功能。GFAP(胶质纤维酸性蛋白)是星形胶质细胞中的主要蛋白,是神经毒性损伤的标志。在铅中毒引起的神经损伤中,GFAP水平升高。Iba-1通常被称为中枢神经系统中的一种微胶质标记物。研究表明,铅暴露诱导小鼠/大鼠海马中GFAP和iba-1的表达增加。值得注意的是,两者的激活都会增加炎症细胞因子的产生和海马变性,并作为氧化应激的刺激物,破坏血脑屏障。在本研究中,Lf312减轻了大脑中的氧化损伤和炎症反应,反映了其在体内对铅离子的吸附。Lf312吸附铅,并在影响血脑屏障之前通过粪便将其排出体外,直接降低了大脑中的铅暴露水平。然而,铅暴露没有安全阈值。即使低水平的铅暴露也会造成氧化损伤,并严重影响神经系统,特别是对铅更敏感的儿童。因此,在仅减少铅的情况下,无法达到有效的缓解,这意味着肠道微生物组也对大脑中的氧化和炎症发挥了保护作用。人们对肠道微生物组在主要维持宿主健康方面的重要性达成了共识,其失衡与许多炎症、免疫和神经相关疾病有关。本研究观察到铅暴露小鼠肠道微生物组α多样性和结构失衡显著降低。这些变化还反映在潜在有益细菌(乳酸菌)的丰度降低和某些条件致病菌(如肠道拟杆菌)的富集上。相比之下,使用Lf312的处理不仅保持了菌群的丰富度,而且还导致了一种更类似于未暴露的对照组的结构。这种情况可能是由于潜在有益细菌的丰度增加,如L. reuteri、B. uniformis、P. distasonis和P. goldsteinii。更重要的是,它们也是产生SCFAs的菌株。研究表明,P. distasonis作为一种潜在的益生菌,可以产生丙酸。在最近的一项重金属研究中,Zheng等人发现,摄入甘草极大地改变了肠道微生物组的结构,导致P. disasonis显著富集,改善肠道代谢,减轻了镉的毒性。类似地,潜在的益生菌P. goldsteinii可能通过丙酸、丁酸和戊酸调节宿主的生理反应,而B. uniformis也促进丁酸的产生。在本研究中,Lf312处理显著提高了乙酸水平,这可能是由于某些关键微生物的显著富集。例如,L. reuteri可促进小鼠乙酸的增加,减少IL-17A的分泌。P. distasonis和P. goldsteinii是糖酵解细菌,可以产生乙酸等糖酵解终产物。此外,Lf312显著恢复的Faecalibaculum rodentium和Lachnospiraceae也属于乙酸的生产者。乙酸可穿过血脑屏障并被大脑吸收,通过肠-脑轴促进宿主健康。乙酸是一种关键的菌落代谢物,也是一种关键的星形胶质细胞特异性能量底物。研究表明,小胶质细胞可以吸收菌落来源的乙酸补充剂,并且补充乙酸可以恢复无菌小鼠的小胶质细胞缺陷。乙酸还具有抗炎特性和减少活性氧的能力,有助于缓解神经炎症。另一方面,宿主肠道中产生乙酸的细菌减少可能导致血脑屏障通透性增加。反过来,肠道微生物组可以利用乙酸来增强肠道屏障,减少宿主铅的吸收。SCFAs水平的升高表明肠道微生物组对大脑的保护作用。大量研究表明,SCFAs是微生物-肠道-大脑轴的关键中间产物。SCFAs可与G蛋白偶联受体或组蛋白脱乙酰酶相互作用,影响心理功能,并通过体液、激素、免疫和神经途径直接或间接作用于大脑。在临床前和临床研究中,SCFAs在神经保护、缓解压力、谷氨酸代谢和神经免疫方面具有重要作用。SCFAs通过膜受体和受体独立机制作用于靶细胞。由SCFAs特异性激活的受体在包括大脑在内的多个组织中表达。此外,SCFAs还可以介导进入靶细胞并发挥作用,包括通过非离子扩散。许多脑部疾病或大脑控制下的生理功能已被确定与SCFA密切相关,如帕金森综合征、睡眠障碍、阿尔茨海默病。简单地说,SCFAs从肠道转移到体循环,穿过血脑屏障并调节不受控制的小胶质细胞和星形胶质细胞,减少炎症和氧化应激,缓解焦虑和抑郁行为。值得注意的是,本研究中ZO-1表达的增强表明了血脑屏障的恢复。大量研究表明,SCFAs可维持血脑屏障的结构完整性,并保护其免受氧化应激,从而保护中枢神经系统免受毒性作用。在一些与大脑相关的研究中,丁酸盐治疗可以降低小鼠血脑屏障的通透性。同样,丙酸可以改善血脑屏障的完整性,并通过信号保护血脑屏障免受氧化应激。菌群的变化直接导致其功能的变化。在Lf312显著校正到正常水平的代谢途径中,香叶基香叶基焦磷酸生物合成、鸟苷核苷酸降解III和硫氨基酸生物合成分别参与生育酚、尿酸和谷胱甘肽的产生,具有抗氧化作用。胆固醇或其他必需的生物分子,如辅酶Q、多酚和类异戊二烯,都是通过甲羟戊酸途径合成的。细胞中需要这些分子来维持膜的完整性、蛋白质异戊二酰化和糖基化,防止氧化损伤。此外,这些通路涉及大多数脑部疾病的病理生理学,包括神经发育和神经退行性疾病。研究表明,焦虑和抑郁患者中与脂多糖生物合成和TCA循环相关的基因表达增加。这涉及到本研究中由于铅暴露导致ADP-L-甘油-β-D-甘露庚糖生物合成和TCA循环VII(乙酸盐生产者)的显著上调。
结论
Lf312可直接在体内吸附铅离子,降低脑组织中铅的富集。Lf312还调节肠道微生物组的结构和功能,不仅涉及与抗氧化、神经发育和神经退行性疾病相关的几种代谢途径的上调,还促进了SCFAs的释放。总体而言,Lf312通过这两种机制,以防止铅暴露引起的氧化损伤和炎症反应,同时维持大脑中的血脑屏障完整性,最终改善小鼠的焦虑和抑郁行为(图7)。这项研究阐明了肠道菌群减轻铅在大脑中的毒性作用的机制,并为儿童大规模铅中毒导致的脑损伤的预防和干预提供了新的预防措施。
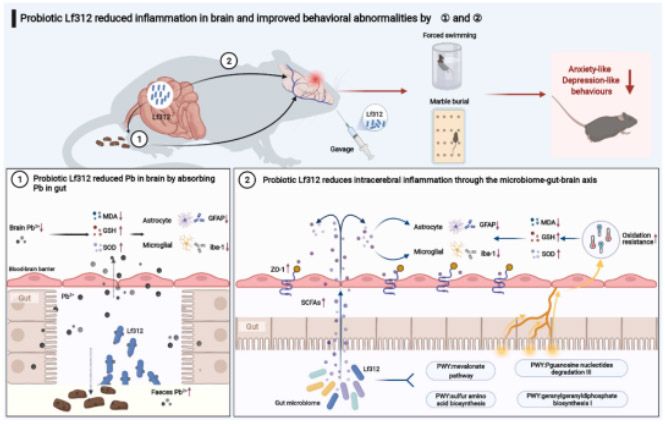
图7 Lf312在体内通过微生物-肠道-脑轴和吸附减轻慢性铅暴露引起的氧化性脑损伤、炎症反应和行为异常的机制。
原文链接:https://www.sciencedirect.com/science/article/pii/S0147651323000477
免责声明:本文仅代表作者个人观点,与中国益生菌网无关。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。
版权声明
1.本站部分转载的文章非原创,其版权和文责属于原作者。2.本网所有转载文章、链接及图片系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,对可以提供充分证据的侵权信息,bio149将在确认后12小时内删除。3.欢迎用户投递原创文章至86371366@qq.com,经审核后发布到首页,其版权和文责属于投递者。















